题目内容
19.下列与实验相关的叙述正确的是( )| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 将SO2和Cl2按等物质的量比例通入品红溶液中,品红很快褪色 | |
| C. | NO2和H2O反应过程中,被氧化的氮原子与被还原的氮原子个数比为2:1 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
分析 A.稀释浓硫酸时,应该将浓硫酸倒入水中,而不是将水倒入浓硫酸中;
B.将SO2和Cl2按等物质的量比例通入品红溶液中,二者发生氧化还原反应生成硫酸和稀盐酸,反应方程式为SO2+Cl2+2H2O=H2SO4+2HCl,硫酸和盐酸都没有漂白性;
C.3NO2+H2O=2HNO3+NO,被氧化的N原子和被还原的N原子个数之比为:2:1;
D.硫酸根离子检验时,应该先加稀盐酸后加氯化钡溶液.
解答 A.稀释浓硫酸时,应该将浓硫酸倒入水中,且不断搅拌,而不是将水倒入浓硫酸中,否则易产生安全事故,故A错误;
B.将SO2和Cl2按等物质的量比例通入品红溶液中,二者发生氧化还原反应生成硫酸和稀盐酸,反应方程式为SO2+Cl2+2H2O=H2SO4+2HCl,硫酸和盐酸都没有漂白性,则混合溶液不褪色,故B错误;
C.3NO2+H2O=2HNO3+NO,N元素化合价由+4价变为+5价、+2价,被氧化的N原子和被还原的N原子个数之比为:2:1,故C正确;
D.硫酸根离子检验时,应该先加稀盐酸后加氯化钡溶液,稀盐酸排除其它离子干扰,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及基本实验操作、氧化还原反应、物质的漂白性、离子检验等知识点,明确物质性质及离子检验方法、基本实验操作等知识点即可解答,易错选项是B.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.某元素R的阴离子R2-核外共有a个电子,核内有b个中子,则能正确表示R原子符号的是( )
| A. | ${\;}_{a+2}^{a+b-2}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{b}^{a}$R | D. | ${\;}_{a+2}^{a+b}$R |
10.下表是元素周期表的一部分,针对表中的①~⑧中元素,按要求用相应的化学用语填空回答.
(1)①为铍(填元素名称),在这些元素中,非金属性最强的元素F(填元素符号),化学性质最不活泼的原子的原子结构示意图为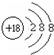 .
.
(2)③⑤⑦元素形成的简单离子,离子半径由小到大的顺序Al3+<F-<Cl-(填离子符号)
(3)④⑦元素形成的化合物的电子式为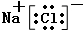 ,②元素形成的单质其结构式为N≡N.
,②元素形成的单质其结构式为N≡N.
(4)用化学式,“<”或“>”比较,②③两元素气态氢化物的稳定性NH3<HF;⑥⑦两元素最高价氧化物对应水化物酸性H2SiO3<HClO4.
(5)④⑤两元素最高价氧化物对应水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 .
.(2)③⑤⑦元素形成的简单离子,离子半径由小到大的顺序Al3+<F-<Cl-(填离子符号)
(3)④⑦元素形成的化合物的电子式为
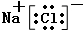 ,②元素形成的单质其结构式为N≡N.
,②元素形成的单质其结构式为N≡N.(4)用化学式,“<”或“>”比较,②③两元素气态氢化物的稳定性NH3<HF;⑥⑦两元素最高价氧化物对应水化物酸性H2SiO3<HClO4.
(5)④⑤两元素最高价氧化物对应水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
7.下列物质中,不能导电的是( )
| A. | 熔化的硝酸钾 | B. | 硝酸钾晶体 | C. | 硝酸钾水溶液 | D. | 稀硝酸 |
11.下列反应水既不作氧化剂也不作还原剂的是( )
| A. | Mg+2H2O$\frac{\underline{\;△\;}}{\;}$Mg(OH)2+H2↑ | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2K+2H2O═2KOH+H2↑ | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
8.“纳米材料”是指微粒直径为几纳米到几十纳米的材料,如将纳米材料分散到水中,得到的分散系不可能具有的性质有下列的( )
| A. | 能全部透过半透膜 | B. | 能全部通过滤纸 | ||
| C. | 粒子做布朗运动 | D. | 有电泳现象 |
9.下列物质中σ键和π键数目比为1:2的是( )
| A. | O2 | B. | HCN | C. | CO2 | D. | N2 |