题目内容
9.下列各组中的离子,能大量共存的是( )| A. | K+、H+、Cl-、CO32- | B. | K+、Cu2+、SO42-、NO${\;}_{3}^{-}$ | ||
| C. | H+、Na+、OH-、Cl- | D. | Mg2+、Al3+、OH-、SO42- |
分析 A.氢离子与碳酸根离子反应;
B.四种离子之间不反应,能够大量共存;
C.氢离子与氢氧根离子反应;
D.镁离子、铝离子都与氢氧根离子反应.
解答 解:A.H+、CO32-之间发生反应,在溶液中不能大量共存,故A错误;
B.K+、Cu2+、SO42-、NO3-之间不发生反应,在溶液中能够大量共存,故B正确;
C.H+、OH-之间发生反应,在溶液中不能大量共存,故C错误;
D.Mg2+、Al3+与OH-之间发生反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查了离子共存的判断,题目难度中等,明确离子反应发生的条件为解答关键,注意掌握常见离子不能共存的情况,如:生成沉淀、气体、弱电解质等,试题培养了学生的灵活运用能力.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
19.现有如下九种物质:①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体
⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3 ⑩NaHSO4
(1)按物质的分类方法,将上述物质的序号填入表格里的编辑框处:
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH-═H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O.
(3)⑨的电离方程式为Al2(SO4)3=2Al3++3SO42-.将34.2g ⑨冷却后溶于水配成250mL溶液,SO42-的物质的量浓度为1.2mol/L.
(4)②与⑧发生反应的化学方程式为:Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),还原剂与氧化剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6mol.
⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3 ⑩NaHSO4
(1)按物质的分类方法,将上述物质的序号填入表格里的编辑框处:
| 分类标准 | 能导电 | 电解质 | 非电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ③⑤⑥⑨⑩ | ④ |
(3)⑨的电离方程式为Al2(SO4)3=2Al3++3SO42-.将34.2g ⑨冷却后溶于水配成250mL溶液,SO42-的物质的量浓度为1.2mol/L.
(4)②与⑧发生反应的化学方程式为:Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),还原剂与氧化剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6mol.
20.已知:CH4+Br2→CH3Br+HBr
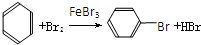
将甲苯和液溴混合在光照下进行反应,得到的产物是( )
①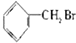 ②
②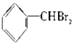 ③
③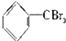 ④
④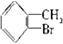 ⑤
⑤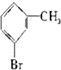
⑥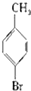 ⑦
⑦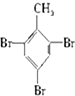
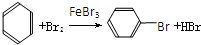
将甲苯和液溴混合在光照下进行反应,得到的产物是( )
①
 ②
② ③
③ ④
④ ⑤
⑤
⑥
 ⑦
⑦
| A. | ①②③ | B. | ⑦ | C. | ④⑤⑥⑦ | D. | 全部 |
17.下列实验所用玻璃仪器名称最少的是( )
| A. | 用CCl4萃取碘水中的I2 | B. | 粗盐(混有泥沙、MgSO4•FeCl3)的提纯 | ||
| C. | 用蒸馏方法分离CCl4和I2的混合物 | D. | 用浓HCl配制一定量浓度的稀HCl |
4. 用如图所示装置分别进行如下实验,测定溶液导电性变化.以下哪个选项为导电性先增大后减弱的为( )
用如图所示装置分别进行如下实验,测定溶液导电性变化.以下哪个选项为导电性先增大后减弱的为( )
 用如图所示装置分别进行如下实验,测定溶液导电性变化.以下哪个选项为导电性先增大后减弱的为( )
用如图所示装置分别进行如下实验,测定溶液导电性变化.以下哪个选项为导电性先增大后减弱的为( )| A. | 向醋酸溶液中加入氨水 | B. | 向AgNO3溶液中加入HCl | ||
| C. | 向盐酸溶液中加入NaCl溶液 | D. | 向H2SO4溶液中加入BaCl2溶液 |
1.将容积为50mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5mL.若向量筒内鼓入氧气后,可以观察到量筒内水柱继续上升,直至量筒内完全被水充满,则原混合气体中NO2和O2体积比是( )
| A. | 43:7 | B. | 18:7 | C. | 4:1 | D. | 22:3 |
19.下列关于实验安全的叙述中正确的( )
| A. | 实验室制备有毒气体应在通风橱中进行,且对尾气进行吸收处理,防止中毒或污染大气 | |
| B. | 酒精灯不慎打翻小面积失火,可用湿抹布扑灭;实验室煤油大面积着火,可用水浇灭 | |
| C. | 氢气还原氧化铜,一般先预热氧化铜,然后通入氢气 | |
| D. | 实验室,少量浓硫酸溅到皮肤上,应立即用碳酸钠溶液冲洗 |