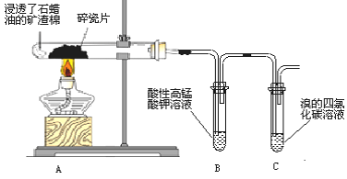
题目内容
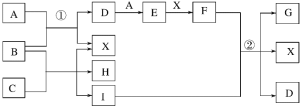
【题目】某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、NH4+、SO42-、SO32-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ( )

A.该溶液X中可能有Fe3+、Na+
B.该溶液可能由是硫酸亚铁、碘化钾和氯化铵溶于水后得到的
C.如果气体Y能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有NH4+
D.取样溶液Z,滴加氯化钡溶液出现沉淀,可推出X中一定存在SO42-、SO32-中的某一种
【答案】B
【解析】
由实验流程可知,与过量氯水反应后的溶液中加入CCl4萃取后下层呈紫红色,说明原溶液中含有I-,则能够氧化I-的Fe3+不能同时存在于溶液中;此时上层的水溶液中一定含有氯水还原生成的Cl-,所以在该溶液中加入AgNO3生成的白色沉淀,不能说明原溶液中是否存在Cl-;另外一份加入NaOH,加热,产生红褐色沉淀说明溶液中存在Fe3+,说明原溶液中含有Fe2+,Fe2+的存在说明原溶液中不含有CO32-和SO32-;生成气体Y,说明原溶液中含有NH4+,Y为氨气;Z的焰色反应为黄色说明含钠离子,但不能确定原溶液中是否含钠离子,透过蓝色钴玻璃观察焰色反应为紫色火焰证明一定含钾离子,结合溶液中各离子浓度相同分析解答。
A.根据上述分析,该溶液X中一定没有Fe3+,故A错误;
B.根据上述分析,该溶液中一定存在K+、Fe2+、I-、NH4+,溶液中各离子浓度相同,根据溶液的电中性原则,溶液中还一定含有SO42-、Cl -,溶液可能是硫酸亚铁、碘化钾和氯化铵溶于水后得到的,故B正确;
C.氨气是碱性气体,不能使湿润的蓝色石蕊试纸变红,此现象不能说明溶液中一定含有NH4+,故C错误;
D.根据上述分析,原溶液中不存在SO32-,故D错误;
故选B。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案