题目内容
【题目】在一定条件下,利用CO2合成CH3OH的反应如下: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1,研究发现,反应过程中会有副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g) △H1,研究发现,反应过程中会有副反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2。温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )
CO(g)+H2O(g) △H2。温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )

A. △H1<0,△H2>0
B. 增大压强有利于加快合成反应的速率
C. 生产过程中,温度越高越有利于提高CH3OH的产率
D. 合成CH3OH反应的平衡常数表达式是K=![]()
【答案】C
【解析】
A.由图可知温度升高CH3OH的产率减小,所以CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的化学平衡逆向移动,则△H1<0;而一氧化碳产率增大,所以CO2(g)+H2(g)
CH3OH(g)+H2O(g)的化学平衡逆向移动,则△H1<0;而一氧化碳产率增大,所以CO2(g)+H2(g)![]() CO(g)+H2O(g)平衡正向移动,△H2>0;
CO(g)+H2O(g)平衡正向移动,△H2>0;
B.对于有气体参与的反应,压强越大反应速率越快;
C.△H1<0升高温度化学平衡向逆反应方向移动;
D.平衡常数等于生成浓度幂之积比上反应物浓度幂之积,由此分析解答。
A.由图可知温度升高CH3OH的产率减小,所以CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)平衡逆向移动,则△H1<0;而一氧化碳产率增大,所以CO2(g)+H2(g)
CH3OH(g)+H2O(g)平衡逆向移动,则△H1<0;而一氧化碳产率增大,所以CO2(g)+H2(g)![]() CO(g)+H2O(g)平衡正向移动,△H2>0,所以△H1<0,△H2>0,A正确;
CO(g)+H2O(g)平衡正向移动,△H2>0,所以△H1<0,△H2>0,A正确;
B.对于有气体参与的反应,压强越大反应速率越快,所以增大压强有利于加快合成反应的速率,B正确;
C.由于△H1<0,所以升高温度化学平衡向逆反应方向移动,故温度越高CH3OH的产率越低,C错误;
D.平衡常数等于生成浓度幂之积比上反应物浓度幂之积,所以合成CH3OH反应的平衡常数表达式是K= K=![]() ,D正确;
,D正确;
故合理选项是C。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO32-、SiO32-、AlO2-、Cl- |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
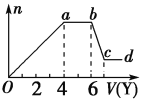
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是________________________,ab段发生反应的离子是________,bc段发生反应的离子方程式为___________________________________。
(2)若Y是NaOH溶液,则X中一定含有的阳离子是____________________, ab段反应的离子方程式为_______________________________________________________________________。
【题目】高炉炼铁过程中发生的反应:1/3Fe2O3(s)+CO(g)2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法正确的是
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
A. △H>0
B. 该反应的平衡常数表达式是![]()
C. 其他条件不变,向平衡体系充入CO2气体,K值减小
D. 其他条件不变,增大压强,平衡往逆向移动




