题目内容
【题目】2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家,一种高能LiFePO4电池多应用于公共交通,结构如图所示。电池中间是聚合物的隔膜,其主要作用是在反应过程中只让Li+通过,原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。下列说法错误的是
LiFePO4+nC。下列说法错误的是
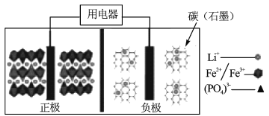
A.放电时,Li+向正极移动
B.放电时,电子由负极→用电器→正极
C.充电时,阴极反应为xLi++nC+xe-=LixCn
D.充电时,当溶液中通过1 mol e-时,阳极质量减小7g
【答案】D
【解析】
A.放电时,该装置为原电池,在原电池中,阳离子向正极移动,即Li+向正极移动,A正确;
B.放电时,该装置为原电池,在原电池中,电子由负极→用电器→正极,B正确;
C.充电时,该装置为电解池,左边为阳极,右边为阴极,阴极得电子,电极反应为xLi++nC+xe-=LixCn,C正确;
D.充电时,该装置为电解池,电子只在导线上传递,不会在溶液中传递,D错误;
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】I.贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
(1)温度为TK时,催化由CO、H2合成CH4反应的热化学方程式为___________。
(2)已知温度为TK时CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 kJ·mol-1的活化能为485.2kJ/mol,则其逆反应的活化能为________kJ/mol。
II.对于反应CO(g)+H2O(g)CO2(g)+H2(g) △H=-41 kJ·mol-1进行以下研究:
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应,测得CO(g)物质的量分数随时间变化如下表所示:
时间/min | 0 | 2 | 5 | 6 | 9 | 10 |
x(CO) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0~5分钟内的速率υ(H2O(g)=_____,6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为___________。
(4)已知700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),发生上述反应,平衡CO体积分数为![]() ,则反应的平衡常数K=______。
,则反应的平衡常数K=______。
(5)在400K、500K时进行上述反应,其中CO和H2的分压随时间变化关系如右图所示,催化剂为氧化铁。实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等。

400K时p(H2)随时间变化关系的曲线是______,500K时p(CO)随时间变化关系的曲线是_______。(填字母序号)
III.在催化剂的作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),是合成甲醇的一种方法。
CH3OH(g),是合成甲醇的一种方法。
(6)某温度下,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应CO(g)+2H2(g)![]() CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________。
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.υ(逆)(CO)=2υ(正)(H2) d.混合气体的密度不再发生改变