题目内容
【题目】I.贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
(1)温度为TK时,催化由CO、H2合成CH4反应的热化学方程式为___________。
(2)已知温度为TK时CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 kJ·mol-1的活化能为485.2kJ/mol,则其逆反应的活化能为________kJ/mol。
II.对于反应CO(g)+H2O(g)CO2(g)+H2(g) △H=-41 kJ·mol-1进行以下研究:
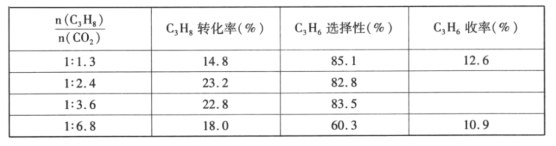
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应,测得CO(g)物质的量分数随时间变化如下表所示:
时间/min | 0 | 2 | 5 | 6 | 9 | 10 |
x(CO) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0~5分钟内的速率υ(H2O(g)=_____,6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为___________。
(4)已知700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),发生上述反应,平衡CO体积分数为![]() ,则反应的平衡常数K=______。
,则反应的平衡常数K=______。
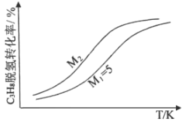
(5)在400K、500K时进行上述反应,其中CO和H2的分压随时间变化关系如右图所示,催化剂为氧化铁。实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等。

400K时p(H2)随时间变化关系的曲线是______,500K时p(CO)随时间变化关系的曲线是_______。(填字母序号)
III.在催化剂的作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),是合成甲醇的一种方法。
CH3OH(g),是合成甲醇的一种方法。
(6)某温度下,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应CO(g)+2H2(g)![]() CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________。
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.υ(逆)(CO)=2υ(正)(H2) d.混合气体的密度不再发生改变
【答案】CO(g)+3H2(g)=CH4(g)+H2O(l) ΔH=-250.4kJ·mol-1 320.2 0.032mol·L-1·min-1 降低温度 ![]() 或者1.32 b d > c d
或者1.32 b d > c d
【解析】
(1)根据盖斯定律计算;
(2)该反应△H>0,为吸热反应,正反应的活化能=△H+逆反应的活化能;
(3)根据表中数据,反应在5min时达到平衡状态,CO物质的量分数为0.1,利用三段式计算υ(H2O);6min时,改变条件达到新平衡时CO的物质的量分数减小,平衡正向移动,结合反应的特点分析;
(4)利用方程式及平衡时CO体积分数为![]() ,推测H2O的体积分数也为
,推测H2O的体积分数也为![]() ,生成的CO2(g)与H2(g)的量相等,占有的体积分数均为
,生成的CO2(g)与H2(g)的量相等,占有的体积分数均为![]() ,再计算K;
,再计算K;
(5)根据平衡时各物质分压的大小确定代表的物质,再依据温度对化学平衡的影响分析判断;
(6)利用K只与温度有关,计算K与Qc的数据判断正、逆反应速率的大小关系;根据平衡状态的本质和特征分析判断。
(1)温度为TK时,①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
根据盖斯定律,将①÷2+②×![]() -③得,则由CO、H2合成CH4反应的热化学方程式为CO(g)+3H2(g)=CH4(g)+H2O(l) ΔH=-250.4kJ·mol-1;
-③得,则由CO、H2合成CH4反应的热化学方程式为CO(g)+3H2(g)=CH4(g)+H2O(l) ΔH=-250.4kJ·mol-1;
(2)该反应△H>0,为吸热反应,正反应的活化能=△H+逆反应的活化能,则逆反应的活化能=485.2kJ/mol-165kJ/mol=320.2 kJ/mol;
(3)根据表中数据,反应在5min时达到平衡状态,CO物质的量的分数为0.1,设消耗的H2O的物质的量为ymol,列出三段式

则![]() =0.1,解得y=1.6,由于该反应反应前后气体分子数不变,平衡时体积仍为10L,则υ(H2O)=
=0.1,解得y=1.6,由于该反应反应前后气体分子数不变,平衡时体积仍为10L,则υ(H2O)=![]() =0.032mol/(Lmin);该反应的正反应是气体体积不变的放热反应,6min时,改变条件达到新平衡时CO的物质的量分数减小,平衡正向移动,则改变的外界条件为降低温度;
=0.032mol/(Lmin);该反应的正反应是气体体积不变的放热反应,6min时,改变条件达到新平衡时CO的物质的量分数减小,平衡正向移动,则改变的外界条件为降低温度;
(4)700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),平衡时CO体积分数为![]() ,根据反应的特点,则H2O的体积分数也为
,根据反应的特点,则H2O的体积分数也为![]() ,生成的CO2(g)与H2(g)的量相等,占有的体积分数均为(1-
,生成的CO2(g)与H2(g)的量相等,占有的体积分数均为(1-![]() ×2)÷2=
×2)÷2=![]() ,由于反应中各物质的化学计量数都为1、且反应前后气体分子数不变,则K=
,由于反应中各物质的化学计量数都为1、且反应前后气体分子数不变,则K= =1.32;
=1.32;
(5) 实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等,由于转化之比等于化学计量数之比,故平衡时p(H2O)和p(CO)相等、p(CO2)和p(H2)相等,该反应的正反应为放热反应,升高温度平衡逆向移动,化学平衡常数减小,根据(4)700K时的平衡常数知,400K、500K的平衡常数都大于1.32,故400K、500K达到平衡时p(H2)>p(CO),则a、b代表p(H2),c、d代表p(CO);升高温度平衡逆向移动,p(H2)减小、p(CO)增大,则400K时p(H2)随时间变化关系的曲线是b,500K时p(CO)随时间变化关系的曲线是d。
(6) 反应CO(g)+2H2(g)CH3OH(g)中消耗1molCO和2molH2转移4mol电子,5 min后,反应达到平衡,此时转移电子6 mol,则反应的n(H2)=3mol、n(CO)=1.5mol,平衡时,CO、H2、CH3OH的物质的量分别为0.5mol、2mol、1.5mol,CO、H2、CH3OH的物质的量浓度分别为0.25mol/L、1mol/L、0.75mol/L,则K=![]() =3;温度未变,再充入2 mol CO和1.5 mol CH3OH,瞬时CO、H2、CH3OH的物质的量浓度分别为1.25mol/L、1mol/L、1.5mol/L,Qc=
=3;温度未变,再充入2 mol CO和1.5 mol CH3OH,瞬时CO、H2、CH3OH的物质的量浓度分别为1.25mol/L、1mol/L、1.5mol/L,Qc=![]() =1.2<K,平衡正向移动,则υ(正)>υ(逆);
=1.2<K,平衡正向移动,则υ(正)>υ(逆);
a.CH3OH的质量不变是反应达到平衡状态的特征,a不选;
b.混合气的总质量始终不变,建立平衡过程中气体分子物质的量改变,则混合气体的平均相对分子质量改变,混合气体的平均相对分子质量不再改变能说明反应达到平衡状态,b不选;
c. υ(逆)(CO)=2υ(正)(H2)时正、逆反应速率不相等,反应没有达到平衡状态,c选;
d. 混合气的总质量始终不变,恒容容器的体积不变,则混合气体的密度一直未发生改变,混合气体的密度不再发生改变不能说明反应达到平衡状态,d选;
答案为cd。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案