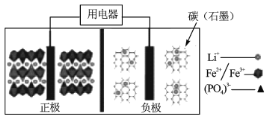
题目内容
【题目】第四周期某些过渡元素在工业生产中有着极其重要的作用。
(1)铬是最硬的金属单质,被称为“不锈钢的添加剂”。写出Cr在周期表中的位置___;其原子核外电子排布的最高能层符号为___。
(2)在1molCrO5(其中Cr为+6价)中,含有过氧键的数目为__。
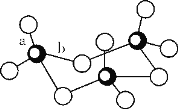
(3)钒(23V)广泛用于催化及钢铁工业,被称之为“工业的味精”。写出钒原子价电子排布图___;V2O5常用作SO2转化为SO3的催化剂。SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为___。
(4)Ni是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物Ni(CO)4,其中配原子是____。(填元素符号)
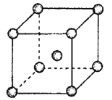
(5)钛称之为21世纪金属,具有一定的生物功能。钙钛矿(CaTiO3)晶体是工业获取钛的重要原料。CaTiO3晶胞如图,边长为a=0.266nm,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为___nm,与Ti紧邻的O个数为___。
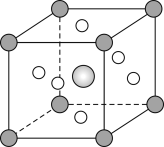
(6)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则Ti处于___位置,O处于___位置。
【答案】第四周期第VIB族 N 2×6.02×1023(或2NA) ![]() sp3 C 0.188 12 体心 棱心
sp3 C 0.188 12 体心 棱心
【解析】
根据化合价之和为0 ,计算过氧键的数目;钒原子价电子排布式为3d34s2,结合泡利原理、洪特规则画出价电子排布图; S原子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断S原子杂化类型;C原子与O原子均含有1对孤对电子,电负性越强越不易提供孤对电子;Ti与O之间的最短距离为晶胞面对角线长度的一半。
(1)Cr为24号元素,在元素周期表中的位置为第四周期第ⅥB族,核外电子排布最高的能级层为第4层,为N层;
(2)过氧根中的氧的化合价为-1价,其他的氧为-2价,则可以设有x个过氧根,有y个氧离子,则根据化合物的化合价代数和为0以及原子守恒,过氧根中有2个O为-1价,则有2x×(-1)+ y×(-2)+5=0,2x+y=5,可以求得x=2,则1molCrO5中含有2mol过氧键,过氧键的数目为2×6.02×1023(或2NA);
(3)V为23号元素,其价电子的排布为3d34s2,则其价电子排布图为![]() ;从示意图可以看出来,每个S原子与4个氧原子形成四面体结构,类似于CH4,故其S原子的杂化类型为sp3;
;从示意图可以看出来,每个S原子与4个氧原子形成四面体结构,类似于CH4,故其S原子的杂化类型为sp3;
(4) Ni(CO)4中,配位原子能够提供电子对,其配位原子是否有孤对电子和电负性有关,O的电负性太大,不易提供电子对,而O的孤对电子配位给C原子,使得C原子一端拥有的电子较多,而且C的电负性没有O大,易给出电子,因此配位原子是C;
(5)晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为面对角线的一半,为![]() ,与Ti紧邻的O,在Ti原子的上部有4个,在与Ti原子同平面的有4个O原子,在Ti原子的下面也有4个O原子,一共12个;
,与Ti紧邻的O,在Ti原子的上部有4个,在与Ti原子同平面的有4个O原子,在Ti原子的下面也有4个O原子,一共12个;
(6) CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,O与Ca在同一直线上,则O在棱上;Ti在Ca形成的六面体的中心,则Ti为体心,所以Ti处于体心,O处于棱心位置。