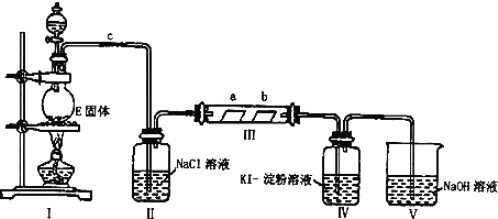
题目内容
【题目】钙钛矿可以制成太阳能电池、发光二极管和催化剂,甚至可以制成未来量子计算机的元件。钙钛矿并不是专指某种含钙和钛的化合物,而是一类具有ABX3组成的晶体材料的总称,其中A和B是阳离子,X是阴离子。
(1)历史上所发现的第一种钙钛矿,是天然矿物钛酸钙(CaTiO3),其中Ti4 +的核外电子排布式为____;钛酸钙中两种阳离子中半径较大的是__。
(2)一种有机卤化铅钙钛矿是由[CH (NH2)2]+、Pb2+和Cl-构成的,这种钙钛矿的化学式为___,在[CH(NH2)2]+中碳原子的杂化方式为____。
(3)2018年我国科学家制得世界首例无金属钙钛矿材料。下列有机阳离子均可用于制备无金属钙钛矿:
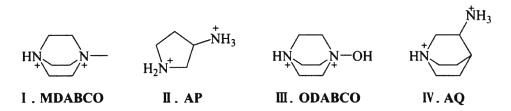
其中含有手性碳原子的是____(填序号)。
(4)如图是CaTiO3的两种晶胞结构示意图,两种晶胞的参数均为a=b=c=379. 5 pm,α=β=γ=90°;
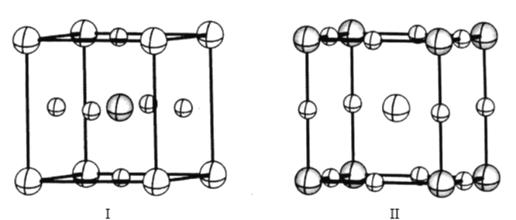
在晶胞I中氧离子占据的是___(填“体心”“面心”或“顶点”),在晶胞II中氧离子之间最近的距离是___pm(列出计算表达式)。
(5)无金属钙钛矿MDABCO—NH4 I3的晶胞类型与CaTiO3相同。若在MDABCO-NH4I3的晶胞中NH4+的分数坐标为(![]() ,
,![]() ,
,![]() ),其中一种I-的分数坐标为(0,0,
),其中一种I-的分数坐标为(0,0,![]() ),则MDABCO的分数坐标为___。与MDABCO 距离最近的I-的个数为____个。
),则MDABCO的分数坐标为___。与MDABCO 距离最近的I-的个数为____个。
【答案】1s22s22p63s23p6 Ca2+ [CH(NH2)2]PbCl3 sp2 Ⅱ和Ⅳ 面心 ![]() (0,0,0) 6
(0,0,0) 6
【解析】
(1)Ti的核电荷数为22,按照电子排布规律写出其电子排布式;Ca2+和Ti4+的离子核外排布相同,核电荷数大,离子半径小;
(2)化合物是电中性的,正负化合价代数和为0;根据[CH(NH2)2]+中碳原子价层电子对数判断杂化轨道方式;
(3)碳原子连接4个不同的原子或原子团时为手性碳原子;
(4) 根据均摊法可知晶胞中含有氧离子数目为3,再结合晶胞I结构分析即可;晶胞II中氧离子位于立方体的棱边上,两个直接相连的棱边上氧离子间的距离最短;
(5)无金属钙钛矿MDABCO—NH4I3的晶胞类型与CaTiO3相同;若在MDABCO-NH4I3的晶胞中NH4+的分数坐标为(![]() ,
,![]() ,
,![]() ),其中一种I-的分数坐标为(0,0,
),其中一种I-的分数坐标为(0,0,![]() ),则NH4+位于立方体的体心,I-位于立方体的棱边上,晶胞类型为晶胞II,即MDABCO位于晶胞的顶点。
),则NH4+位于立方体的体心,I-位于立方体的棱边上,晶胞类型为晶胞II,即MDABCO位于晶胞的顶点。
(1) Ti的核电荷数为22,其电子排布式为1s22s22p63s23p63d24s2,则Ti4 +的核外电子排布式为1s22s22p63s23p6;Ca2+和Ti4+的离子核外排布相同,核电荷数大,离子半径小,即Ca2+半径比Ti4+大;
(2) 有机卤化铅钙钛矿是由[CH (NH2)2]+、Pb2+和Cl-构成的,结合化合物电中性及原子的最简式整数比原则,这种钙钛矿的化学式为[CH(NH2)2]PbCl3;在[CH(NH2)2]+中碳原子价层电子对数为3,无孤对电子,则碳原子的杂化方式为sp2;
(3) 碳原子连接4个不同的原子或原子团时为手性碳原子,则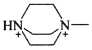 和
和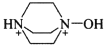 中无含手性碳原子;
中无含手性碳原子;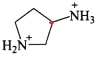 和
和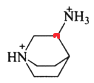 分子结构中红色标注的碳原子,均连接4个不同的原子或原子团,为手性碳原子,故答案为Ⅱ和Ⅳ;
分子结构中红色标注的碳原子,均连接4个不同的原子或原子团,为手性碳原子,故答案为Ⅱ和Ⅳ;
(4)在CaTiO3的晶胞I含有体心离子数有1个,顶点离子数为8×![]() =1,面心离子数为6×
=1,面心离子数为6×![]() =3,则氧离子占据的是面心;晶胞II中氧离子位于立方体的棱边上,两个直接相连的棱边上氧离子间的距离最短,氧离子之间最近的距离是
=3,则氧离子占据的是面心;晶胞II中氧离子位于立方体的棱边上,两个直接相连的棱边上氧离子间的距离最短,氧离子之间最近的距离是![]() ×
×![]() =
=![]() pm;
pm;
(5)在MDABCO-NH4I3的晶胞中NH4+的分数坐标为(![]() ,
,![]() ,
,![]() ),其中一种I-的分数坐标为(0,0,
),其中一种I-的分数坐标为(0,0,![]() ),则NH4+位于立方体的体心,I-位于立方体的棱边上,晶胞类型为CaTiO3晶胞II,即MDABCO位于晶胞的顶点,分数坐标为(0,0,0);与MDABCO 距离最近的I-的个数为3×8×
),则NH4+位于立方体的体心,I-位于立方体的棱边上,晶胞类型为CaTiO3晶胞II,即MDABCO位于晶胞的顶点,分数坐标为(0,0,0);与MDABCO 距离最近的I-的个数为3×8×![]() =6。
=6。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】近年来科学家制造出大量的新物质,对下列三种物质的相关说法错误的是( )
|
|
|
石墨烯:从石墨中分离出来,是最薄、最坚硬的纳米材料 | 石墨炔:平面网状结构的全碳分子,具有优良的化学稳定性 | 纳米碳管:具有优良的场发射性能,制作成阴极显示管、储氢材料 |
A. 石墨烯具有良好的导电性
B. 上述三种物质与金刚石互为同素异形体
C. 石墨炔孔径略大于H2分子的直径,可作H2的提纯薄膜
D. 上述三种物质与浓硫酸都能发生反应,但反应产物不同