题目内容
【题目】(1)写出下列反应的热化学方程式:
①.N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量: __________。
②1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(g),放出1366.8kJ的热量:________ 。
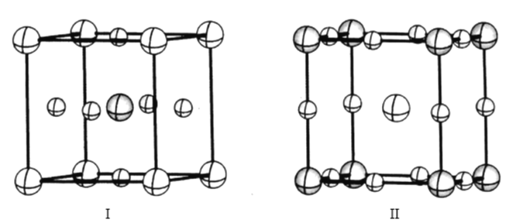
(2)101 kPa条件下,氮气和氢气反应生成氨气的能量变化示意图如下:

已知:a=1127;b=1219,则:1molN2和3molH2参与反应生成2molNH3________(填“吸收”或“放出”)热量_____kJ。
【答案】N2(g)+3H2(g)=2NH3(g) △H=-92.2kJ/mol C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ/mol 放出 184
【解析】
(1)①N2和H2完全反应生成1molNH3放热46.1kJ热量,生成2mol氨气放热92.2kJ,据此书写热化学方程式;
②标注物质聚集状态和对应反应焓变写出热化学方程式;
(2)反应热=反应物中的键能之和与生成物中的键能之和的差,根据反应物和产物能量高低判断反应热的正负及反应过程的能量变化数值的多少。
(1)①N2和H2完全反应生成1molNH3放热46.1kJ热量,生成2mol氨气放热92.2kJ,标注物质聚集状态和对应反应焓变写出热化学方程式为:N2(g)+3H2(g)=2NH3(g) △H=-92.2kJ/mol;
②1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8kJ热量,标注物质聚集状态和对应反应焓变写出热化学方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ/mol;
(2)根据图示知道反应物的能量高于生成物的能量,所以该反应放热,反应热=反应物的键能-生成物的键能,氮气和氢气反应生成氨气的热化学方程式为:![]() N2(g)+
N2(g)+![]() H2(g)= NH3(g) △H=a-bkJ/mol,则N2(g)+ H2(g)=2NH3(g), △H=2(a-b)kJ/mol=2(1127-1219)kJ/mol=-184kJ/mol。即:1molN2和3molH2参与反应生成2molNH3气放出184kJ的热量。
H2(g)= NH3(g) △H=a-bkJ/mol,则N2(g)+ H2(g)=2NH3(g), △H=2(a-b)kJ/mol=2(1127-1219)kJ/mol=-184kJ/mol。即:1molN2和3molH2参与反应生成2molNH3气放出184kJ的热量。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】实验小组制备NaNO2,并探究其性质。
I.制备NaNO2
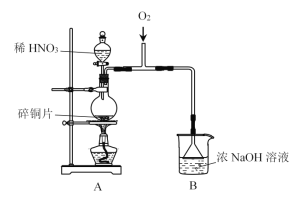
(1)A中发生反应的化学方程式是__________。
(2)B中选用漏斗替代长直导管的优点是________。
(3)为检验B中制得NaNO2,甲进行以下实验:
序号 | 试管 | 操作 | 现象 |
① | 2 mLB中溶液 | 加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 不变蓝 |
② | 2 mLB中溶液 | 滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 变蓝 |
③ | 2 mLH2O | 滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 不变蓝 |
实验③的目的是________。
(4)乙认为上述3组实验无法证明B中一定含NaNO2,还需补充实验,理由是_________。
II.探究NaNO2的性质
装置 | 操作 | 现象 |
| 取10 mL1 mol/LNaNO2溶液于试剂瓶中,加入几滴H2SO4酸化,再加入10 mL1 mol/LFeSO4溶液,迅速塞上橡胶塞,缓缓通入足量O2。 | i.溶液迅速变为棕色; ii.溶液逐渐变浅,有无色气泡产生,溶液上方为浅红棕色。 iii.最终形成棕褐色溶液。 |
资料:i.[Fe(NO)]2+在溶液中呈棕色。
ii.HNO2在溶液中不稳定,易分解产生NO和NO2气体。
(5)溶液迅速变为棕色的原因是_________。
(6)已知棕色溶液变浅是由于生成了Fe3+,反应的离子方程式是_________。
(7)最终棕褐色溶液的成分是Fe(OH)x(SO4)y,测得装置中混合溶液体积为20 mL,设计如下实验测定其组成。
资料:充分反应后,Fe2+全部转化为Fe(OH)x(SO4)y。
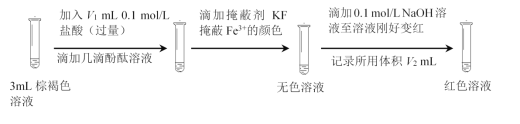
Fe(OH)x(SO4)y中x=_______(用含V1、V2的代数式表示)。