题目内容
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
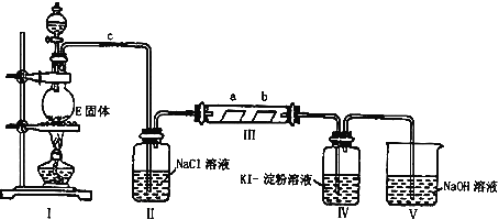
(1)有关氯气、氯水和氯离子的性质,下列说法正确的是___。
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.Cl-和Cl2都具有很强的氧化性
C.新制氯水可以用来杀菌消毒是因为生成强酸次氯酸
D.将新制氯水滴入AgNO3溶液,会出现白色沉淀
(2)装置Ⅱ中饱和食盐水的作用是___。
(3)实验室以二氧化锰和浓盐酸制备氯气的离子方程式为:___。
(4)实验过程中,装置IV中的实验现象为__;发生反应的化学方程式为__。
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加如图中的__装置![]() 填序号
填序号![]() ,该装置的作用是__。
,该装置的作用是__。

(6)装置Ⅴ的目的是防止尾气污染,写出装置Ⅴ中发生反应的离子方程式__。
【答案】AD 除去Cl2中的HCl气体 MnO2+4H+ +2Cl-![]() Mn2+ +Cl2↑+2H2O 无色溶液变蓝色 Cl2+2KI=I2+2KCl ④ 干燥Cl2 Cl2+2OH-=Cl-+ClO-+H2O
Mn2+ +Cl2↑+2H2O 无色溶液变蓝色 Cl2+2KI=I2+2KCl ④ 干燥Cl2 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)依据氯气是黄绿色气体、氯水中溶有氯气、氯离子和银离子生成氯化银沉淀解答;
(2)依据饱和食盐水可除去氯气中的氯化氢解答;
(3)依据二氧化锰和浓盐酸加热反应生成氯气、氯化锰和水解答;
(4)依据氯气置换出碘化钾中的碘单质,碘单质遇到淀粉变蓝解答;
(5)依据用浓硫酸干燥氯气解答;
(6)依据氢氧化钠和氯气反应生成氯化钠、次氯酸钠和水解答;
(1)A.氯水中含有Cl2,氯气是浅黄绿色气体,A项正确;
B.Cl的化合价为氯元素的最低价,只具有还原性,Cl2具有很强的氧化性,B项错误;
C.新制氯水可以用来杀菌消毒是因为生成次氯酸具有氧化性,和强酸无关,C项错误;
D.将新制氯水滴入AgNO3溶液,氯气和水反应生成的盐酸中的氯离子结合银离子生成白色沉淀,D项正确;
故答案为:AD;
(2)装置Ⅱ中饱和食盐水的作用是除去氯气中的氯化氢气体,
故答案为:除去Cl2中的HCl气体;
(3)实验室以二氧化锰和浓盐酸加热反应生成氯气,发生反应的离子方程式为:![]() ;
;
(4)实验过程中,有氯气通过装置IV中,氯气置换出碘化钾中的碘单质,反应的方程式为Cl2+2KI=I2+2KCl,反应生成的碘单质遇到淀粉变蓝。
故答案为:无色溶液变蓝色;Cl2+2KI=I2+2KCl;
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象是因为制取的氯气没有干燥,因此应该还需在图中装置Ⅱ与Ⅲ之间添加浓硫酸做干燥装置,作用是干燥氯气,
故答案为:④;干燥Cl2;
(6)装置Ⅴ的目的是用氢氧化钠吸收剩余的氯气,防止尾气污染,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案