题目内容
(12分)Ⅰ.(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 ________(填“促进”、“抑制”)其水解。
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
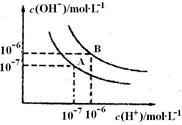
Ⅱ. 已知水在25 ℃(A)和T ℃(B)时,其电离平衡曲线如图所示:
(1)25 ℃时,将pH=3 的H2SO4溶液与pH=10的NaOH溶液混合,若所得混合溶液的pH=7,则H2SO4溶液与NaOH溶液的体积比为 。
(2)T ℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强Ⅰ碱的pH2之间应满足的关系是 。
(3)曲线B对应温度下,pH=3的HCl溶液和pH=9的某碱溶液等体积混合后,混合溶液的pH>7。请分析其原因: 。
Ⅰ.(1)酸,< ,Ag++H2O  AgOH+H+ ,抑制。(2)NaOH溶液
AgOH+H+ ,抑制。(2)NaOH溶液
Ⅱ. (1)1∶10 (2)a+b=13或pH1+pH2=13
(3) 该碱为弱碱, 中和后混合溶液中还剩余较多的弱碱分子,可继续电离出OH-,使溶液呈碱性。
解析试题分析:Ⅰ.(1)AgNO3是强酸弱碱盐,弱碱根离子水解消耗水电离产生的OH-,使盐的水溶液呈酸性。常温时的pH<7。水解的两种方程式是Ag++H2O  AgOH+H+。实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。(2)硫化钠是强碱弱酸盐,弱酸根离子水解消耗水电离产生的H+,使溶液显碱性。在配制硫化钠溶液时,为了防止发生水解,可以加入少量的NaOH溶液。Ⅱ. (1) 25 ℃时H2SO4是强酸,pH=3,c(H+)=10-3mol/L;pH=10的NaOH,c(H+)=10-10mol/L;由于在25 ℃时Kw=10-14,所以c(OH-)=10-4mol/L. 由于所得混合溶液的pH=7,所以V(酸) ·c(H+)= V(碱) ·c(OH-);所以V(酸) :V(碱) = c(OH-):c(H+)=10-4mol/L:10-3mol/L=1:10;(2)在T ℃时Kw=10-12. 10体积pH1=a的溶液V(酸) ·c(H+)=10×10-a=10(1-a); 1体积pH2=b的某强碱, V(碱) ·c(OH-)=1×10-12÷10-b=10(b-12).由于混合后溶液呈中性,所以10(1-a)=10(b-12)。所以a+b=13或pH1+pH2=13。(3)在曲线B对应温度下,Kw=10-12.pH=3的HCl溶液c(H+)=10-3mol/L, pH=9的某碱溶液c(OH-)=10-12÷10-9mol/L=10-3mol/L,等体积混合后,若该碱为强碱,则恰好中和,混合溶液的pH=7。但是现在溶液的pH>7,说明碱过量。该碱为弱碱,在溶液中存在大量的弱碱分子。电离的部分恰好与酸中和,由于破坏了弱碱的电离平衡,碱会继续电离出OH-,使溶液呈碱性。
AgOH+H+。实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。(2)硫化钠是强碱弱酸盐,弱酸根离子水解消耗水电离产生的H+,使溶液显碱性。在配制硫化钠溶液时,为了防止发生水解,可以加入少量的NaOH溶液。Ⅱ. (1) 25 ℃时H2SO4是强酸,pH=3,c(H+)=10-3mol/L;pH=10的NaOH,c(H+)=10-10mol/L;由于在25 ℃时Kw=10-14,所以c(OH-)=10-4mol/L. 由于所得混合溶液的pH=7,所以V(酸) ·c(H+)= V(碱) ·c(OH-);所以V(酸) :V(碱) = c(OH-):c(H+)=10-4mol/L:10-3mol/L=1:10;(2)在T ℃时Kw=10-12. 10体积pH1=a的溶液V(酸) ·c(H+)=10×10-a=10(1-a); 1体积pH2=b的某强碱, V(碱) ·c(OH-)=1×10-12÷10-b=10(b-12).由于混合后溶液呈中性,所以10(1-a)=10(b-12)。所以a+b=13或pH1+pH2=13。(3)在曲线B对应温度下,Kw=10-12.pH=3的HCl溶液c(H+)=10-3mol/L, pH=9的某碱溶液c(OH-)=10-12÷10-9mol/L=10-3mol/L,等体积混合后,若该碱为强碱,则恰好中和,混合溶液的pH=7。但是现在溶液的pH>7,说明碱过量。该碱为弱碱,在溶液中存在大量的弱碱分子。电离的部分恰好与酸中和,由于破坏了弱碱的电离平衡,碱会继续电离出OH-,使溶液呈碱性。
考点:考查盐的水解平衡、弱电解质的电离平衡、酸碱溶液混合时溶液的pH的计算的知识.

把0.2 mol?L-1CH3COOH溶液与0.1 mol?L-1 NaOH溶液等体积混合,溶液显酸性,下列叙述正确的是
| A.c(CH3COO-)>c(Na+) |
| B.c(CH3COOH)> c(CH3COO-) |
| C.c(CH3COOH)+ c(CH3COO-)=0.1mol?L-1 |
| D.加入少量NaOH固体,c(Na+)增大而c(CH3COO-)减小 |
下列混合溶液中,各离子浓度的大小顺序不正确的是( )
| A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) + c(CH3COOH)=2c(Na+) |
| B.物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合: 离子浓度的大小顺序是: c (Na+)>c (HCO3-)> c(CO32-)>c(OH-)> c(H+) |
| C.CH3COONa溶液中c(OH-) = c(CH3COOH) +c(H+) |
| D.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
(12分)常温下,将某一元碱BOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HCl的物质的量浓度 (mol·L-1) | BOH的物质的量浓度 (mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH>7 |
(1)从第①组情况分析,BOH是 (选填“强碱”或“弱碱”)。该组所得混合溶液中由水电离出的
c(OH—)= mol·L-1。
(2)第②组情况表明,c 0.2。该混合液中离子浓度c(B+) c(Cl—)(选填“<”、“>”或“=”)。
(3)从第③组实验结果分析,混合溶液中 (选填“<”、“>”或“=”)
甲:BOH的电离程度 BCl的水解程度
乙:c(B+)—2 c (OH—) c(BOH)—2 c(H+)
(16分)钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是 (用离子方程式表示)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:
正极的电极反应式为 ,电池工作时物质A可循环使用,A物质的化学式为 。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 11.6 | 10.3 | 11.1 |
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为 。
②已知几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
 )>c(SO
)>c(SO )>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .
)>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .