题目内容
下列混合溶液中,各离子浓度的大小顺序不正确的是( )
| A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) + c(CH3COOH)=2c(Na+) |
| B.物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合: 离子浓度的大小顺序是: c (Na+)>c (HCO3-)> c(CO32-)>c(OH-)> c(H+) |
| C.CH3COONa溶液中c(OH-) = c(CH3COOH) +c(H+) |
| D.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
D
解析试题分析:选项A中根据物料守恒可知,物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合后c(CH3COO-) + c(CH3COOH)=2c(Na+),A正确;选项B中由于碳酸钠的水解程度大于碳酸氢钠的水解程度,则物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合中离子浓度的大小顺序是: c (Na+)>c (HCO3-)>c(CO32-) >c(OH-)>c(H+),B正确;选项C中醋酸钠水解,则根据质子守恒可知,c(OH-)=c(CH3COOH) +c(H+),C正确;选项D中根据质子守恒可知,1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),D不正确,答案选D。
考点:考查溶液中离子浓度大小比较
点评:该题是高考中的常见题型,属于综合性试题的考查,对学生的思维能力提出了较高的要求,本题贴近高考,综合性强,侧重对学生能力的培养,意在培养学生的逻辑推理能力和创新思维能力。该题的关键是在明确反应原理的基础上利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,然后结合题意灵活运用即可。

现有常温下的四份溶液:①0.01 mol/L CH3COOH;②0.01 mol/L HCl;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
| A.①中水的电离程度最小,③中水的电离程度最大 |
| B.将②、③混合,若有pH=7,则消耗溶液的体积:②>③ |
| C.将①、④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| D.将四份溶液分别稀释100倍后,溶液的pH:③>④,①>② |
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(1) [B(OH)4]-(aq)+H+(aq)。
[B(OH)4]-(aq)+H+(aq)。
下列说法正确的是
| 化学式 | 电离常数(298K) |
| 硼酸 | K=5.7×10-10 |
| 碳酸 | K1=4.4×10-7 K=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气 泡产生
B.将一滴醋酸溶液滴入碳酸溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
| A.溶液中Ca2+ 数目增多 | B.溶液中c(Ca2+)增大 |
| C.溶液pH值不变 | D.溶液pH值增大 |
向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示。下列判断正确的是( ) 
| A.x=20 |
| B.稀H2SO4的浓度为0.10mol/L |
| C.b点有:2c(NH4+) = c(SO42-)> c(H+) = c(OH-) |
| D.a点有:c(NH4+) < 2c(SO42-) |
含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是:
A.Na2SO3溶液中存在: |
B.已知NaHSO3溶液 ,该溶液中: ,该溶液中: |
C.当吸收液呈中性时: |
D.当吸收液呈酸性时: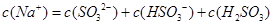 |
(8分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下: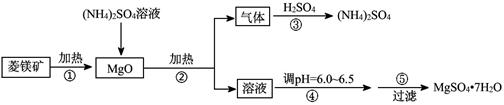
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH(C6H5OH相当于一元弱酸):
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O。若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是______________(填编号)。
A.CO2+H2O+2NaClO=Na2CO3+2HClO
B.CO2+H2O+NaClO=NaHCO3+HClO
C.CO2+H2O+C6H5ONa―→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa―→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH―→NaHCO3+C6H5ONa
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol·L-1的下列六种物质的溶液中,pH最小的是________(填编号);其pH等于________(填数值);pH最大的是________(填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO
⑤H2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其他的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体根据上述反应,总结出复分解反应发生的另一规律___________________________________________
将KI溶液和AgCl固体混合搅拌,会观察到的现象是____________________________________,请写出反应的离子方程式______________________________________________
