题目内容
11.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )| A. | pH=12的溶液:NO3-、I-、Na+、Al3+ | |
| B. | 0.1mol.L-1CH3COONa溶液:Mg2+、H+、Cl-、SO42- | |
| C. | Kw/c(H+)=0.1mol•L-1 的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 0.1mol•L-1KMnO4溶液:Na+、Mg2+、N03-、S032- |
分析 A.pH=12的溶液中存在大量氢氧根离子,铝离子与氢氧根离子反应;
B.醋酸钠与氢离子反应生成弱电解质醋酸;
C.该溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
D.高锰酸根离子具有强氧化性,能够氧化亚硫酸根离子;镁离子与亚硫酸根离子反应.
解答 解:A.pH=12的溶液为碱性溶液,溶液中存在大量氢氧根离子,Al3+与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.CH3COONa与H+之间发生反应,在溶液中吧大量共存,故B错误;
C.Kw/c(H+)=0.1mol•L-1的溶液为碱性溶液,Na+、K+、SiO32-、NO3-之间不发生反应,都不与碱性溶液中的氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.S032-与KMnO4、Mg2+发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;是“可能”共存,还是“一定”共存等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
1.在容积固定的密闭容器中发生反应:2NO+O2?2NO2,不能判断该反应达到到平衡状态的是( )
| A. | 单位时间内生成nmolO2的同时,生成2nmolNO2 | |
| B. | NO2?NO?O2反应速率的比为2:2:1 | |
| C. | 混合气体的颜色不再改变的状态 | |
| D. | 混合气体的压强不再改变的状态 |
2.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+6H++2H3AsO3═2As+3SnCl62-+6M,关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3、②还原性:As>SnCl2、③每生成1mol As,反应中转移电子的物质的量为3mol、④M为OH-、⑤SnCl62-是氧化产物.
①氧化剂是H3AsO3、②还原性:As>SnCl2、③每生成1mol As,反应中转移电子的物质的量为3mol、④M为OH-、⑤SnCl62-是氧化产物.
| A. | ①③⑤ | B. | ①②④⑤ | C. | ①②③④ | D. | 只有①③ |
6.下列化学反应中,HCl部分被氧化的是( )
| A. | NaOH+HCl=NaCl+H2O | B. | 4HCl+MnO2=Cl2↑+MnCl2+2H2O | ||
| C. | HCl+AgNO3=AgCl↓+HNO3 | D. | CaO+2HCl=CaCl2+H2O |
16.一定量的金属Cu完全溶于适量浓硝酸中,收集到混合气体(含NO、N2O4、NO2),将上述混合气体平均分为两份,一份与标准状况下4.48L O2混合后,用水吸收生成HNO3且无气体剩余,另一份恰好能被500 mL 1mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,则其中的NaNO2的物质的量为( )
| A. | 0.1mol | B. | 0.15mol | C. | 0.2mol | D. | 0.4mol |
3.聚四氟乙烯可以作为不粘锅的内衬,其结果简式是( )
| A. |  | B. | 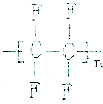 | C. | 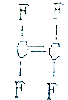 | D. | 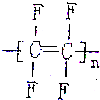 |
5.下列说法不正确的是( )
| A. | 法国科学家拉瓦锡用定量化学实验阐述了燃烧的氧化学说,推翻了燃素说 | |
| B. | 俄国科学家门捷列夫制作出世界上第一张元素周期表 | |
| C. | 意大利科学家阿伏伽德罗发现了阿伏伽德罗常数 | |
| D. | 英国科学家道尔顿提出了近代原子学说 |
6.如表对应关系不正确的是( )
| 序号 | 俗称 | 主要成分 | 主要作用或用途 |
| A | 漂白粉 | Ca(ClO)2和CaCl2 | 可做漂白剂或环境消毒剂 |
| B | 硅胶 | H2SiO3 | 可做实验室或袋装食品、瓶装药品的干燥剂 |
| C | 石英 | SiO2 | 可做饰品、光纤材料以及半导体材料等 |
| D | 纯碱 | Na2CO3 | 可用于造纸、制玻璃等 |
| A. | A | B. | B | C. | C | D. | D |