题目内容
8.将b mol Na2O2和a mol NaHCO3混合放在密闭容器中,加热至300℃,使其充分反应,回答下列问题:(1)当充分反应后,密闭容器内的气体只有氧气时,a和b的关系式是$\frac{b}{a}$≥1;
(2)当充分反应后,密闭容器内的固体只有Na2CO3时,a和b的关系式是$\frac{b}{a}$≤$\frac{1}{2}$;
(3)当充分反应后,密闭容器内的固体是Na2CO3和NaOH混合物时,a和b的关系式是$\frac{1}{2}$<$\frac{b}{a}$<1.
分析 混合物在密闭容器中加热到300℃时,可能发生如下反应:
①2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2,
②2Na2O2+2CO2═2Na2CO3+O2,
③2Na2O2+2H2O═4NaOH+O2,
④2NaOH+CO2═Na2CO3+H2O,
由上述反应,可得总的反应方程式为:
Ⅰ、Na2O2+2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+$\frac{1}{2}$O2↑+H2O↑
Ⅱ、2Na2O2+2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+O2↑+2NaOH
(1)容器内的气体只有氧气时,发生反应Ⅱ;
(2)当剩余固体为Na2CO3,发生反应Ⅰ,碳酸氢钠可能过量;
(3)当剩余固体为Na2CO3、NaOH时,发生反应Ⅰ、Ⅱ.
解答 解:混合物在密闭容器中加热到300℃时,可能发生如下反应:
①2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2,
②2Na2O2+2CO2═2Na2CO3+O2,
③2Na2O2+2H2O═4NaOH+O2,
④2NaOH+CO2═Na2CO3+H2O,
由上述反应,可得总的反应方程式为:
Ⅰ、Na2O2+2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+$\frac{1}{2}$O2↑+H2O↑
Ⅱ、2Na2O2+2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+O2↑+2NaOH
(1)容器内的气体只有氧气时,发生反应Ⅱ,过氧化钠可能剩余,故$\frac{b}{a}$≥1,故答案为:$\frac{b}{a}$≥1;
(2)当剩余固体为Na2CO3,发生反应Ⅰ,碳酸氢钠可能过量,故$\frac{b}{a}$≤$\frac{1}{2}$,故答案为:$\frac{b}{a}$≤$\frac{1}{2}$;
(3)当剩余固体为Na2CO3、NaOH时,发生反应Ⅰ、Ⅱ,故$\frac{1}{2}$<$\frac{b}{a}$<1,故答案为:$\frac{1}{2}$<$\frac{b}{a}$<1.
点评 本题考查混合物的有关计算等,难度较大,注意利用总反应方程式分段讨论,由于二氧化碳与氢氧化钠反应,故可以认为过氧化钠先与二氧化碳反应,反应完毕过氧化钠有剩余再与水反应.

 我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,电池总反应为:4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )
我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,电池总反应为:4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )| A. | 铝板是电池的正极 | |
| B. | 电池工作时铝板逐渐被消耗 | |
| C. | 电池工作时实现了化学能向电能的转化 | |
| D. | 将铂电极做成网状,可增大与氧气的接触面积 |
| A. | 0.1mol | B. | 0.15mol | C. | 0.2mol | D. | 0.4mol |
| A. |  | B. | 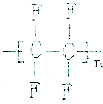 | C. | 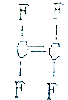 | D. | 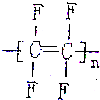 |
| A. | 法国科学家拉瓦锡用定量化学实验阐述了燃烧的氧化学说,推翻了燃素说 | |
| B. | 俄国科学家门捷列夫制作出世界上第一张元素周期表 | |
| C. | 意大利科学家阿伏伽德罗发现了阿伏伽德罗常数 | |
| D. | 英国科学家道尔顿提出了近代原子学说 |
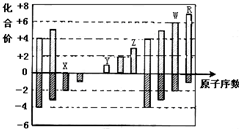
| A. | WX3和水反应形成的化合物是弱电解质 | |
| B. | 气态氢化物的还原性:R>W | |
| C. | 离子半径:Z>Y>X | |
| D. | Y、Z、R三种元素分别形成的最高价氧化物对应的水化物两两间能发生反应 |
| A. | AgNO3溶液、乙醇溶液、苯酚的水溶液、烧碱溶液 | |
| B. | 乙酸、甲酸甲酯、乙酸乙酯 | |
| C. | 乙醛溶液、硝基苯、淀粉溶液、花生油、氯仿 | |
| D. | 苯、四氯化碳、1-已烯、苯酚的水溶液 |