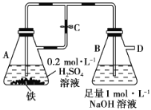
��Ŀ����
����Ŀ����1��Brλ��Ԫ�����ڱ���_____���ڵ�_____�壻��̬Na+������_____���˶�״̬��ͬ�ĵ��ӣ�Mg��̬ԭ�Ӻ�������Ų�ʽΪ_____��
��2���á�����������գ�
��һ������ | ���Ӱ뾶 | �۵� | ���ļ��� |
N_____S | S2��_____ Mg2+ | SO3______Na2O2 | H��O_____H��N |
��3����֪�����Ʃ��崢�ܵ����һ�ֶ��ε�أ��ṹ��ͼ������ܷ�ӦΪ��2Na2S3+2NaBr![]() 3Na2S2+Br2��
3Na2S2+Br2��
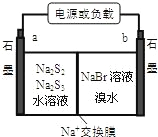
�ٷŵ�ʱNa+��_____��Ǩ�ƣ��a �� b������
�ڳ��ʱ�����缫��ӦʽΪ��______________��
��4����֪N4Ϊ��������ṹ��N��N����Ϊ167kJ/mol��N��N ����Ϊ 942kJ/mol��д ��N4��g��ת��ΪN2��g�����Ȼ�ѧ����ʽ________________��
���𰸡� �� ��A 10 1s22s22p63s2 �� �� �� �� b 2S32��+2e��=3S22�� N4��g��=2N2��g����H=��882kJ/mol
��������
(1)Br��ԭ������Ϊ35��ԭ�ӽṹ����4�����Ӳ�������������Ϊ7��Na��������Ϊ11����̬Na+������10��������Mg��̬ԭ�Ӻ���12��������
(2)�ǽ�����Խǿ����һ������Խ�������Ӳ�Խ�������Ӱ뾶Խ�������Ӿ�����۵���ڷ��Ӿ�����۵���O�ķǽ����Ա�N��ǿ������ļ���ǿ��
(3) ��ԭ��������������������ƶ����ڳ��ʱ�������Դ��������,�����õ����ӷ�����ԭ��Ӧ��
(4)����Ϣ����֪��N4��g��=2N2��g�� ��H=6��E��N��N����2��E��N��N�����Դ��������
��1��Br��ԭ������Ϊ35��ԭ�ӽṹ����4�����Ӳ㣬����������Ϊ 7����λ�ڵ������ڢ�A�壻Na��������Ϊ 11����̬ Na+������10�����ӣ�����10���˶�״̬��ͬ�ĵ��ӣ�Mg��̬ԭ�Ӻ��� 12�����ӣ����̬ԭ�Ӻ�������Ų�ʽΪ 1s22s22p63s2��
��ˣ������Ϊ���ģ���A��10��1s22s22p63s2��
��2���ǽ�����N��S����һ������ N��S�����Ӳ�Խ�࣬���Ӱ뾶Խ�������Ӱ뾶ΪS2����Mg2+�����Ӿ�����۵���ڷ��Ӿ�����۵㣬���۵�Ϊ SO3��Na2O2��O�ķǽ����Ա� N ��ǿ������ļ���ΪH��O>H��N��
��ˣ������Ϊ��>��>��<��>��
��3���ɵ�ط�Ӧ��֪���ŵ�ʱ��Br2�õ����ӣ�S22��ȥ���ӣ���aΪ������bΪ��������ԭ����У��������������ƶ����� Na+�� b�ƶ��ڳ��ʱ�������Դ���������������õ����ӷ�����ԭ��Ӧ�������缫��ӦʽΪ2S32��+2e��=3S22����
��ˣ������Ϊ��b��2S32��+2e��=3S22����
��4������Ϣ��֪ N4��g��=2N2��g�� ��H=6��E��N��N����2��E��N��N��=6��167kJ/mol��2��942kJ/mol=��882kJ/mol�����Ȼ�ѧ����ʽΪ N4��g��=2N2��g����H=��882kJ/mol��
��ˣ������Ϊ��N4��g��=2N2��g����H=��882kJ/mol��

����Ŀ��������������������������Ҫ�������������ĺ�����������NaClO2��NaClO��ClO2 ��Cl2
�ش�����������
��1��NaClO2�����Ļ�ѧ��������________________��
��2��������Ͷ��ˮ����һ��ʱ����백��ϵõ�һ�ֽ�����Ȱ�(NH2Cl)��NH2Cl �����Ի�����������Ҳ��һ��ǿɱ���������������ڳ�������ˮ��������������________________���û�ѧ����ʽ��ʾ����
��3�� ����Ч�Ⱥ��������������������������������������䶨����ÿ�˺��������������������൱�ڶ��ٿ�Cl2 �������������������ֺ���������������������ǿ����________________��
��4������ˮ����ClO2 �������ˮ����Ҫ��ClO2 ��Ũ����0.1~0.8 mg��L-1֮�䡣�õ��������ClO2 �����������ˮ��ClO2 Ũ�ȵ�ʵ�鲽��������
������.ȡһ�������ˮ�������������⻯������������������Һ���������������������Һ��
������.��Na2S2O3 ��Һ�ζ������������õ���Һ��
��֪��a. ����ʱ����ͬpH �����������������±���ʾ��
pH | 2 | 7 |
�������� | Cl- | ClO2- |
b. 2S2O32-+I2==S4O62-��2I-��
���������з�Ӧ����ʱ��Һ��___________��������ɫ��������ɫ����
����ˮ�������Ϊ1.0L���ڲ�����������10mL1.0��10-3mol��L-1Na2S2O3 ��Һ�����ˮ����c(ClO2)=___________mg��L-1