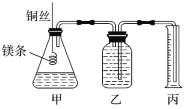
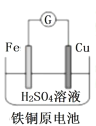
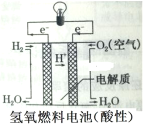
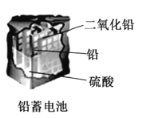
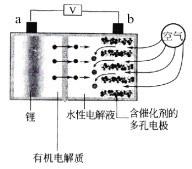
题目内容
【题目】现有以下物质:①盐酸;②二氧化碳;③高锰酸钾;④铝;⑤自来水;⑥石墨;⑦液氧;⑧淀粉;⑨纯碱
(1)以上物质能导电的是_______________
(2)以上物质属于电解质的是___________
(3)以上物质属于非电解质的是_________
(4)从上述物质选出一种或几种进行反应,写出既是氧化还原反应,又是化合反应的化学方程式:____________。
【答案】①④⑤⑥ ③⑨ ②⑧ ![]() (点燃条件下或常温下均可)或
(点燃条件下或常温下均可)或![]()
【解析】
(1)含可自由移动电子或离子的物质能导电,据此回答;
(2) 在水溶液中或熔融状态下能导电的化合物叫做电解质,常见的酸、碱、盐大多是电解质,据此回答;
(3) 蔗糖、酒精等化合物,无论是在水溶液中还是在熔融状态下均以分子形式存在,因而不能导电,这样的化合物叫做非电解质,葡萄糖、淀粉、油脂等有机化合物大多是非电解质,据此回答;
(4) 石墨和氧气或者铝和氧气的反应符合,据此写化学方程式;
(1)铝、石墨因含可自由移动电子能导电,盐酸是电解质溶液,因含可自由移动的离子能导电,水是极弱的电解质,能导电;
答案为:①④⑤⑥;
(2) 在水溶液中或熔融状态下能导电的化合物叫做电解质,常见的酸、碱、盐大多是电解质,提供的物质中③高锰酸钾⑨纯碱都是盐,都属于电解质;
答案为:③⑨;
(3) 蔗糖、酒精等化合物,无论是在水溶液中还是在熔融状态下均以分子形式存在,因而不能导电,这样的化合物叫做非电解质,葡萄糖、淀粉、油脂等有机化合物大多是非电解质,虽然二氧化碳的水溶液能导电,但离子由碳酸电离产生而二氧化碳自身不直接电离出离子,故二氧化碳属于非电解质;
答案为:②⑧;
(4) 石墨和氧气或者铝和氧气的反应符合,则化学方程式为![]() (点燃条件下或常温下均可)或
(点燃条件下或常温下均可)或![]() ;
;
答案为:![]() (点燃条件下或常温下均可)或
(点燃条件下或常温下均可)或![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醇(在水中溶解度不大、易溶于有机溶剂,密度约等于水的密度)和苯甲酸。反应原理如下:2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa、C6H5COONa+HCl→C6H5COOH+NaCl,有关物质物理性质如表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | ﹣15 | 12 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21 g | 0.34 g | 5.9 g |
实验流程如下:
(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。若将仪器B改为仪器C,效果不如B,说明原因________。
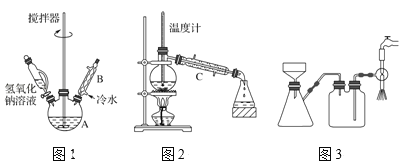
(2)操作中有关分液漏斗的使用不正确的是___。
A.分液漏斗在使用之前必须检查是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时等下层液体放完后立即关闭旋塞,换一个烧杯再打开旋塞使上层液体流下
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集___℃的馏分。图2中有一处明显错误,正确的应改为_______。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用___冲洗杯壁上残留的晶体,抽滤完成后洗涤晶体。
(5)用电子天平准确称取0.244 0 g苯甲酸样品于锥形瓶中,加100 mL蒸馏水溶解(必要时可以加热),再用0.100 0 molL﹣1的标准NaOH溶液滴定,共消耗NaOH溶液19.20 mL,则苯甲酸样品的纯度为___%(保留4位有效数字)。
【题目】按要求回答下列问题:
(1)在200℃、101kPa时,0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,该反应的热化学方程式表示为____。
(2)根据键能数据估算
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
CH4(g)+4F2(g) =CF4(g)+4HF(g)的反应热ΔH为______kJ/mol
(3) 已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
a、b、c均大于0 则:反应①中,ΔS______(选填“>”、“<”或“=”)0;
2C(s)+4H2(g)+O2(g) = 2CH3OH(l) ΔH=_______kJ/mol。