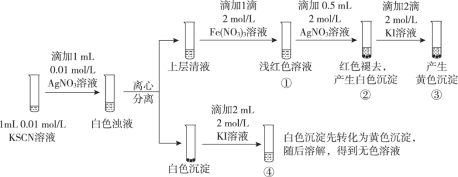
题目内容
【题目】按要求回答下列问题:
(1)在200℃、101kPa时,0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,该反应的热化学方程式表示为____。
(2)根据键能数据估算
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
CH4(g)+4F2(g) =CF4(g)+4HF(g)的反应热ΔH为______kJ/mol
(3) 已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
a、b、c均大于0 则:反应①中,ΔS______(选填“>”、“<”或“=”)0;
2C(s)+4H2(g)+O2(g) = 2CH3OH(l) ΔH=_______kJ/mol。
【答案】H2(g) + I2(g) ![]() 2HI(g) △H=-14.9kJ/mol -1940 > a-2b-2c
2HI(g) △H=-14.9kJ/mol -1940 > a-2b-2c
【解析】
(1)H2和I2反应方程式为H2+I2=2HI,即1molH2参与反应放出热量为7.45kJ×1mol/0.5mol=14.9kJ,热化学反应方程式为H2(g)+I2(g)![]() 2HI(g) △H=-14.9kJ/mol;
2HI(g) △H=-14.9kJ/mol;
(2)根据△H=反应物键能总和-生成物键能总和=(4×414+4×155-4×489-4×565)kJ·mol-1=-1940kJ·mol-1;
(3)①CH3OH为液体,其余为气体,反应①中熵增,即△S>0;根据目标方程式,有①-②×2-2③得出△H=(a-2b-2c)kJ·mol-1。

 阅读快车系列答案
阅读快车系列答案【题目】氯化镁纯品为无色单斜晶体,工业品通常呈黄褐色,有苦咸味。该物质可以形成六水合物,即六水氯化镁(MgCl2·6H2O),以下流程为由某混合物,制取纯净MgCl2·6H2O的生产过程:
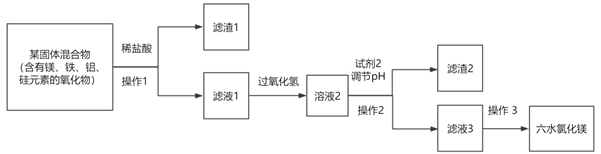
已知:在本流程中,
Fe3+ | Fe2+ | Al3+ | Mg2+ | |
开始沉淀pH | 1.5 | 6.5 | 3.3 | 8.4 |
完全沉淀pH | 4.1 | 9.7 | 5.5 | 10.9 |
试回答下列问题:
(1)操作1所需玻璃仪器为____________________。
(2)流程中加入试剂2调节pH的范围是________;加入试剂2能形成沉淀的原因是___________________。
(3)操作3为加入足量的盐酸,然后经过___________、____________,过滤,洗涤,干燥;在操作不当的情况下,若MgCl2·6H2O受热则会发生水解形成碱式盐,则该反应的化学方程式为____________________。
(4)若25℃下,Ksp[Mg(OH)2]=4×10-12,则该温度下,将Mg(OH)2溶于水形成饱和溶液,则其饱 和溶液的pH=_________。(已知:lg5=0.7)