题目内容
【题目】某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积。该小组设计的简易实验装置如图所示:
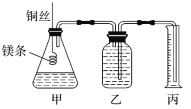
该实验的主要操作步骤如下:
①用已知浓度的浓盐酸配制100mL 1.0mol·L-1的盐酸(需要用到的仪器有量筒、烧杯、__________;
②用10mL的量筒量取8.0mL 1.0mol·L-1的盐酸加入锥形瓶中;
③准确称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为_____;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请回答下列问题:
(1)步骤①中,配制100mL 1.0mol·L-1的盐酸时,下列会使所配制溶液的浓度偏小的操作有____(填字母)。
A 用量筒量取浓盐酸时,俯视量筒的刻度线
B 容量瓶未干燥即用来配制溶液
C 浓盐酸在烧杯中稀释时,搅拌时间过长
D 定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线未做处理
E 在容量瓶中定容时俯视容量瓶刻度线
F 烧杯中有少量水
G 未冷却至室温即定容
(2)实验步骤⑤中应选用的量筒规格是_______
(3)读数时需要注意(至少写两点):______。
(4)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm=___L·mol-1。
【答案】100mL容量瓶,胶头滴管 0.096 AC 100mL 恢复室温;乙丙两液面相平;视线与量筒中液体凹液面最低处相平 0.25V
【解析】
根据一定物质的量浓度溶液的配制操作方法及注意事项分析解答;根据实验装置分析反应过程及相关变化;根据已知条件进行物质的量计算。
步骤①用浓盐酸配制100mL 1.0molL-1的盐酸时,需用量筒量取浓盐酸,在烧杯中稀释,要用玻璃棒不断搅拌,最后用胶头滴管对100mL容量瓶进行定容;
步骤③Mg与盐酸发生的反应为Mg+2HCl=MgCl2+H2↑,8.0mL 1.0molL-1盐酸中n(HCl)=8.0×10-3L×1.0molL-1=8.0×10-3mol,完全反应时消耗Mg为4.0×10-3mol,其质量为4.0×10-3mol×24gmol-1=0.096g;
(1)A.用量筒量取浓盐酸时,俯视量筒的刻度会使所量取溶液的体积减小,使所配制的溶液的浓度偏小,故A符合;
B.容量瓶未干燥即用来配制溶液对所配制的溶液的浓度没有影响,故B不符合;
C.浓盐酸在烧杯中稀释时,搅拌时间过长会因盐酸溶液中的溶质挥发使所配制的溶液的浓度偏低,故C符合;
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线不会对所配制的溶液的浓度有影响,故D不符合;
E.在容量瓶中定容时俯视容量瓶刻度线会使容量瓶中的液体的体积偏小,所配制的溶液浓度偏大,故E不符合;
F.烧杯中有少量水对配制的溶液的浓度无关,故F不符合;
G.未冷却至室温即定容会使加入水的体积偏小,所配制的溶液浓度偏大,故G不符合;
故选AC;
(2)8.0mL 1.0molL-1盐酸与Mg完全反应放出4.0×10-3mol H2,其在标准状况下的体积为4.0×10-3mol×22.4L/mol=0.0896L=89.6mL,故应选取体积为100mL的量筒;
(3)量筒读数时需要注意:①恢复到室温再读数;②调节量筒高度,使量筒内的液体与集气瓶内的液面相平;③读数时眼睛视线应与量筒中液体的凹液面最低处保持相平;
(4)HCl完全反应时生成4.0×10-3mol H2,实验中收集到VmL H2,则该条件下的气体摩尔体积为Vm=![]() =0.25V Lmol-1。
=0.25V Lmol-1。

【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMn![]() 时,z=___________。
时,z=___________。

