��Ŀ����
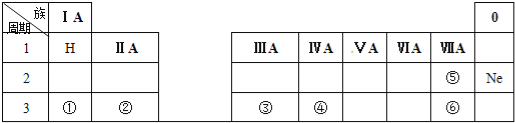
����Ŀ��2NO��g��+O2��g��2NO2��g����H��0�������������Ҫ��Ӧ֮һ����800��ʱ�����ݻ�Ϊ1L���ܱ������г���0.010mol NO��0.005molO2����Ӧ������NO��Ũ����ʱ��仯��ͼ��ʾ��
��ش�
��1��2min�ڣ�v��O2��= mol/��Lmin����
��2�������¶ȣ�ƽ���� ����������桱����Ӧ�����ƶ���
��3��ƽ��ʱ��NO��ת������ ��
��4��800��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ����ֵΪ ��
���𰸡���1��1.25��10��3��2���棨3��50%��4��400
���������⣺��1����ͼ���֪NOŨ�ȵı仯����v��NO��=![]() =0.025mol/��Lmin������v��O2��=
=0.025mol/��Lmin������v��O2��=![]() v��NO��=1.25��10��3mol/��Lmin����
v��NO��=1.25��10��3mol/��Lmin����
�ʴ�Ϊ��1.25��10��3��
��2������Ӧ���ȣ��������¶�ƽ�������ƶ����ʴ�Ϊ���棻
��3����ʼʱc��NO��=0.010mol/L��ƽ��ʱc��NO��=0.005mol/L����֪ת����Ϊ![]() =50%���ʴ�Ϊ��50%��
=50%���ʴ�Ϊ��50%��
��4��2NO��g��+O2��g��2NO2��g��
��ʼ 0.01 0.005 0
ƽ��0.005 0.0025 0.005
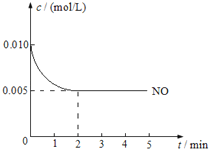
��k=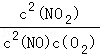 =
=![]() =400��
=400��
�ʴ�Ϊ��400��

����Ŀ��
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����____________������ţ�������������Һ�����õ��IJ���������______________�����������ƣ���
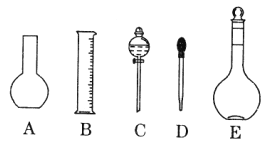
��2������ƿ�����������6���е�_________________������ţ�
�� �¶� ��Ũ�� ������ ��ѹǿ ���̶��� ����ʽ���ʽ
��3������ƿ��_________������ţ���
A������һ�����ȷŨ�ȵı���Һ |
B��������Һ |
C����������ƿ������µ����������Һ�� |
D��ȷϡ��ijһŨ�ȵ���Һ |
E�����������ܽ��������
��4�����ݼ�����������ƽ��ȡNaOH������Ϊ__________g��������Ͳ��ȡ��������Ϊ98%���ܶ�Ϊ1.84 g/cm3��Ũ��������Ϊ��__________mL������������һλС�����������ƹ����У����в��������������ƫ�ߵ���____________������ţ���
�� δ��ϡ�ͺ��H2SO4��Һ��ȴ�����¾�ת�Ƶ�����ƿ�ж���
�� ����ʱ��������ˮ�����̶��ߣ����ý�ͷ�ι�����
�� ����ҡ�Ⱥ���Һ����ڿ̶��ߣ����ý�ͷ�ιܼ�����ˮ���̶���
�� ����ʱ�����ӿ̶���
����Ŀ���Ȼ����dz�����ˮ�����������÷���м���Ʊ���ˮ�Ȼ�����ʵ�����Ʊ�װ�ú�ҵ�Ʊ�����ͼ���£�
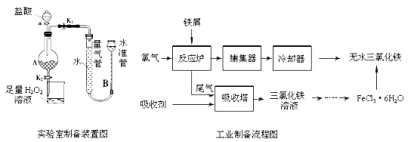
��֪����1����ˮFeCl3���۵�Ϊ555K���е�Ϊ588K��
��2������м�е����ʲ������ᷴӦ
��3����ͬ�¶�����ˮ���Ȼ�����ˮ�е��ܽ�����£�
�¶�/�� | 0 | 20 | 80 | 100 |
�ܽ����g/100gH2O�� | 74.4 | 91.8 | 525.8 | 535.7 |
ʵ�����Ʊ������������£�
��.���ɼ�K1���رյ��ɼ�K2��������a�������μ����ᡣ
��.��ʱ���رյ��ɼ�K1�����ɼ�K2����A����Һ��ȫ�����ձ���رջ���a��
��.���ձ�����Һ����һϵ�в�����õ�FeCl3��6H2O���塣
��ش�
��1���ձ���������H2O2��Һ�������ǡ�
��2��Ϊ�˲ⶨ����м�����������������������С���������������__________��
��3����FeCl3��Һ�Ƶ�FeCl36H2O����IJ��������ǣ����������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
��4����д���������з�Ӧ�����ӷ���ʽ����
��5���������¶ȳ���673Kʱ��������Է�������Ϊ325�������Ȼ�������ʵķ���ʽΪ��
��6��FeCl3����������ͨ�����õ������ⶨ����ȡmg��ˮ�Ȼ�����Ʒ������ϡ���ᣬ���Ƴ�100mL��Һ��ȡ��10.00mL�������Թ�����KI��Һ����ַ�Ӧ���뼸�ε�����Һ������cmolL-1Na2S2O3��Һ�ζ�������VmL����֪��I2+2S2O32-�T2I-+S4O62-����
�ٵζ������п������ʵ����ƫ�͵���
A����ƿδ��ϴ
B����ƿ����Һ��ɫ������ֹͣ�ζ������ж���
C���ζ��ܼ����ڵζ�ǰ�����ݣ��ζ��յ㷢������
D���ζ��յ�ʱ���Ӷ���
����Ʒ���Ȼ�������������