��Ŀ����
����Ŀ��
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����____________������ţ�������������Һ�����õ��IJ���������______________�����������ƣ���
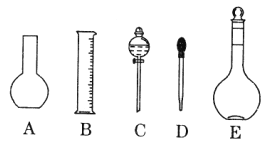
��2������ƿ�����������6���е�_________________������ţ�
�� �¶� ��Ũ�� ������ ��ѹǿ ���̶��� ����ʽ���ʽ
��3������ƿ��_________������ţ���
A������һ�����ȷŨ�ȵı���Һ |
B��������Һ |
C����������ƿ������µ����������Һ�� |
D��ȷϡ��ijһŨ�ȵ���Һ |
E�����������ܽ��������
��4�����ݼ�����������ƽ��ȡNaOH������Ϊ__________g��������Ͳ��ȡ��������Ϊ98%���ܶ�Ϊ1.84 g/cm3��Ũ��������Ϊ��__________mL������������һλС�����������ƹ����У����в��������������ƫ�ߵ���____________������ţ���
�� δ��ϡ�ͺ��H2SO4��Һ��ȴ�����¾�ת�Ƶ�����ƿ�ж���
�� ����ʱ��������ˮ�����̶��ߣ����ý�ͷ�ι�����
�� ����ҡ�Ⱥ���Һ����ڿ̶��ߣ����ý�ͷ�ιܼ�����ˮ���̶���
�� ����ʱ�����ӿ̶���
���𰸡���1��AC �ձ��������� ��2���٢ۢ�
��3��BCE ��4��2.0 13.6 �٢�
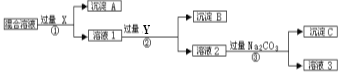
�������������������1������ͼ����ʾ�����Ĺ����֪��A��B��C��D��E�ֱ�Ϊƽ����ƿ����Ͳ����Һ©������ͷ�ιܡ�����ƿ������һ�����ʵ���Ũ����Һ��Ҫ��������Ҫ��������ƽ����Ͳ���ձ�����������500 mL����ƿ����ͷ�ιܣ���˲���ҪAC������֮�⣬����Ҫ�IJ�������Ϊ�ձ�������������2������ƿ�Ĺ�����ͼ��ʾ
 ��ƿ����ƿ���Ϸֱ�����̶��ߡ��������¶ȣ�20������û��Ũ�ȡ�ѹǿ����ʽ���ʽ����ѡ�٢ۢ�����3��A������ƿ��������һ�����ȷŨ�ȵı���Һ��B������ƿ������Һ������������Һ��������ҺӦ���Լ�ƿ��C��һ�ֹ�������ƿֻ������һ���������Һ����������С����������������Һ�壬ֻ�ܰ��մ����ԭ��ѡ������ƿ����100 < 250 < 450 < 500 < 1000�����0.1 mol/L NaOH��Һ450 mL����ѡ��500 mL����ƿ��D������ƿ��Һ����ԭ�Ͽ����ǹ��壬Ҳ������Ũ��Һ����˿�ȷijһŨ�ȵ���Һ��E������ƿ��ֻ��ע�볣�£�20��������Һ������ֱ���������ܽ��ϡ�ͣ���Ϊ�����ܽ��ϡ�Ϳ��ܷ��Ȼ����ȣ�������������������Һ��Ũ�����ϴ�ѡBCE����4�����ݴ����ԭ����ѡ��500mL����ƿ����0.1 mol/L NaOH��Һ�������m=nM=cVM����ʱ�����ܰ������·�������0.1 mol/L��450��10-3L��40g/mol = 1.8g��Ӧ��0.1 mol/L��500��10-3L��40g/mol = 2.0g��������ƽ�ľ�ȷ��Ϊ0.1g����������Ũ��������Ϊx mL������Vw��֪���ʵ�����Ϊ1.84 g/cm3��x mL��98%����m=nM=cVM��֪�����ʵ�����Ϊ0.51 mol/L��500��10-3L��98g/mol������ϡ��ǰ�����ʵ�������ȿɵã�1.84 g/cm3��x mL��98% =" 0.51" mol/L��500��10-3L��98g/mol����ã�x=13.9mL����Ͳ�ľ�ȷ��Ϊ0.1 mL������������������
��ƿ����ƿ���Ϸֱ�����̶��ߡ��������¶ȣ�20������û��Ũ�ȡ�ѹǿ����ʽ���ʽ����ѡ�٢ۢ�����3��A������ƿ��������һ�����ȷŨ�ȵı���Һ��B������ƿ������Һ������������Һ��������ҺӦ���Լ�ƿ��C��һ�ֹ�������ƿֻ������һ���������Һ����������С����������������Һ�壬ֻ�ܰ��մ����ԭ��ѡ������ƿ����100 < 250 < 450 < 500 < 1000�����0.1 mol/L NaOH��Һ450 mL����ѡ��500 mL����ƿ��D������ƿ��Һ����ԭ�Ͽ����ǹ��壬Ҳ������Ũ��Һ����˿�ȷijһŨ�ȵ���Һ��E������ƿ��ֻ��ע�볣�£�20��������Һ������ֱ���������ܽ��ϡ�ͣ���Ϊ�����ܽ��ϡ�Ϳ��ܷ��Ȼ����ȣ�������������������Һ��Ũ�����ϴ�ѡBCE����4�����ݴ����ԭ����ѡ��500mL����ƿ����0.1 mol/L NaOH��Һ�������m=nM=cVM����ʱ�����ܰ������·�������0.1 mol/L��450��10-3L��40g/mol = 1.8g��Ӧ��0.1 mol/L��500��10-3L��40g/mol = 2.0g��������ƽ�ľ�ȷ��Ϊ0.1g����������Ũ��������Ϊx mL������Vw��֪���ʵ�����Ϊ1.84 g/cm3��x mL��98%����m=nM=cVM��֪�����ʵ�����Ϊ0.51 mol/L��500��10-3L��98g/mol������ϡ��ǰ�����ʵ�������ȿɵã�1.84 g/cm3��x mL��98% =" 0.51" mol/L��500��10-3L��98g/mol����ã�x=13.9mL����Ͳ�ľ�ȷ��Ϊ0.1 mL������������������![]() =c�����Ʊ���������n�Ĵ�С�У���û�У�Ӱ��ʱ����V�Ĵ�С��û�У����У�Ӱ�죻����δ��ϡ�ͺ��H2SO4��Һ��ȴ�����¾�ת�Ƶ�����ƿ�ж��ݣ��������n��Ӱ�죬����ʹVƫС�����
=c�����Ʊ���������n�Ĵ�С�У���û�У�Ӱ��ʱ����V�Ĵ�С��û�У����У�Ӱ�죻����δ��ϡ�ͺ��H2SO4��Һ��ȴ�����¾�ת�Ƶ�����ƿ�ж��ݣ��������n��Ӱ�죬����ʹVƫС�����![]() ����c��ƫ�ߣ���������ʱ��������ˮ�����̶��ߣ����ý�ͷ�ι��������������n��Ӱ�죬����ʹVƫ�����
����c��ƫ�ߣ���������ʱ��������ˮ�����̶��ߣ����ý�ͷ�ι��������������n��Ӱ�죬����ʹVƫ�����![]() ����c��ƫ�ͣ���������ҡ�Ⱥ���Һ����ڿ̶��ߣ����ý�ͷ�ιܼ�����ˮ���̶��ߣ��������n��Ӱ�죬����ʹVƫ�����
����c��ƫ�ͣ���������ҡ�Ⱥ���Һ����ڿ̶��ߣ����ý�ͷ�ιܼ�����ˮ���̶��ߣ��������n��Ӱ�죬����ʹVƫ�����![]() ����c��ƫ�ͣ���������ʱ�����ӿ̶��ߣ����������VƫС������n��Ӱ�죬������
����c��ƫ�ͣ���������ʱ�����ӿ̶��ߣ����������VƫС������n��Ӱ�죬������![]() ����c��ƫ�ߣ���ѡ�٢���
����c��ƫ�ߣ���ѡ�٢���

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�����Ŀ��
��1����Ҫ����NaOH���� �ˣ�
��2������ȡ�ܶ�Ϊ1.19g/cm3����������Ϊ36.5%��Ũ����________mL��
��3������ʱ�IJ����ǣ�����������ƿ�м�����ˮ�� �����ý�ͷ�ιܵμ�����ˮ�� ��
��4�����ƹ����У�����ʵ��������������Ƶ�ϡ��������ʵ���Ũ��ƫ����� ��
A����ȡŨ����ʱ������Ͳ���ɾ�����ˮϴ����ֱ����ȡ |
B������Ͳ��ȡŨ����ʱ���ӹ۲찼Һ�� |
C��ϡ��Ũ����ʱ��û����ȴ������ת�Ƶ�����ƿ�� |
D������ʱ���ӿ̶��� |
E��������ˮʱ���������˿̶��ߣ��ý���ι�����
F�����ݺ���ҡ�ȡ����ã�����Һ���½����ټ�����������ˮ