题目内容
【题目】下列物质中,物质的量最大的是___________,含分子个数最多的是____________,含原子个数最多的是___________,质量最大的是___________。
A.6 g H2
B.0.5 mol CO2
C.1.20×1024个HCl分子
D.148 g H2SO4
E.92 g乙醇(C2H5OH)
F.4℃时10 mL水
【答案】A A E D
【解析】
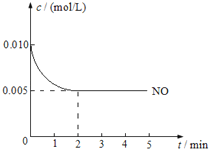
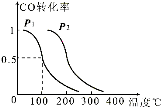
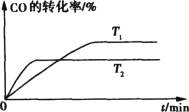
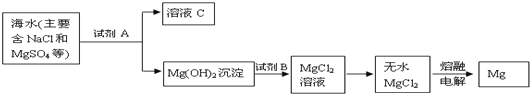
试题分析:根据题意,先用![]() 、
、![]() 、
、![]() 将已知质量、粒子数、体积、密度等转换为n,则6 g H2、1.20×1024个HCl、148 g H2SO4、92 gC2H5OH、4℃时10 mL水分别为3 mol H2、1.99 mol HCl、1.51 mol H2SO4、2 mol C2H5OH、0.56 mol H2O,由于3 > 2 > 1.99 > 1.51 > 0.56 > 0.5,则6 g H2的物质的量最大;再由nNA = N可知,6 g H2所含分子个数最多;然后分子组成关系式:H2~2原子、CO2~3原子、HCl~2原子、H2SO4~7原子、C2H5OH~9原子、H2O~3原子可知,上述分子所含原子的n分别为2×3 mol=6 mol、3×0.5 mol=1.5 mol、2×1.99 mol=3.98 mol、7×1.51 mol=10.57 mol、9×2 mol=18 mol、3×0.56 mol=1.68 mol,由于18 > 10.57 > 6 > 3.98 > 1.68 > 1.5,则92 g乙醇(C2H5OH)所含原子个数最多;最后由nM = m或ρV = m可知,上述分子的质量分别为6 g、0.5×44g=22g、1.99×36.5g=72.635g、148 g、92 g、10×1g=10g,则148 g H2SO4的质量最大。
将已知质量、粒子数、体积、密度等转换为n,则6 g H2、1.20×1024个HCl、148 g H2SO4、92 gC2H5OH、4℃时10 mL水分别为3 mol H2、1.99 mol HCl、1.51 mol H2SO4、2 mol C2H5OH、0.56 mol H2O,由于3 > 2 > 1.99 > 1.51 > 0.56 > 0.5,则6 g H2的物质的量最大;再由nNA = N可知,6 g H2所含分子个数最多;然后分子组成关系式:H2~2原子、CO2~3原子、HCl~2原子、H2SO4~7原子、C2H5OH~9原子、H2O~3原子可知,上述分子所含原子的n分别为2×3 mol=6 mol、3×0.5 mol=1.5 mol、2×1.99 mol=3.98 mol、7×1.51 mol=10.57 mol、9×2 mol=18 mol、3×0.56 mol=1.68 mol,由于18 > 10.57 > 6 > 3.98 > 1.68 > 1.5,则92 g乙醇(C2H5OH)所含原子个数最多;最后由nM = m或ρV = m可知,上述分子的质量分别为6 g、0.5×44g=22g、1.99×36.5g=72.635g、148 g、92 g、10×1g=10g,则148 g H2SO4的质量最大。