题目内容
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
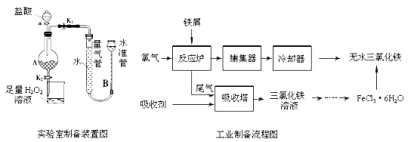
已知:(1)无水FeCl3的熔点为555K、沸点为588K。
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是__________。
(3)从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:。
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为。
(6)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用cmolL-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定过程中可能造成实验结果偏低的是
A.锥形瓶未润洗
B.锥形瓶中溶液变色后立刻停止滴定,进行读数
C.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
D.滴定终点时仰视读数
②样品中氯化铁的质量分数
【答案】(1)把亚铁离子全部氧化成三价铁离子
(2)装置A中不产生气泡或量气管和水准管液面不变(其他合理答案也给分)
(3)盐酸(4)2Fe2++Cl2=2Fe3+(5)Fe2Cl6
(6)①BC②![]()
【解析】
试题分析:(1)根据实验装置和操作步骤可知,实验室制备无水FeCl3,是利用铁与盐酸反应生成FeCl2,然后把FeCl2氧化成FeCl3,先制得FeCl3·6H2O晶体,再脱结晶水制得无水FeCl3。烧杯中足量的H2O2溶液是作氧化剂,把亚铁离子全部氧化成三价铁离子;
(2)铁与盐酸反应完全时,不再产生氢气,所以装置A中不产生气泡或量气管和水准管的液面不再变化,此时,可将A中FeCl2溶液放入烧杯中进行氧化。
(3)为了防止氯化铁水解,则从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入浓盐酸后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4)从工业制备流程图分析可知,反应炉中进行的反应是2Fe+3Cl2=2FeCl3,因此,进入吸收塔中的尾气是没有参加反应的氯气,在吸收塔中氯气被吸收剂吸收,反应后生成FeCl3溶液,所以吸收剂应是FeCl2溶液,反应的离子方程式为:2Fe2++Cl2=2Fe3+。
(5)捕集器收集的是气态FeCl3,FeCl3的相对分子质量是162.5,由相对分子质量为325的铁的氯化物可以推出,当温度超过673K时,二分子气态FeCl3可以聚合生成双聚体Fe2Cl6。(备注:FeCl3属共价型化合物,能溶于乙醚、丙酮等有机溶剂,在673K蒸气中有双聚体,1023K以上分解为单分子)。
(6)①A.锥形瓶未润洗消耗标准液体积增加,测定结果偏高;
B.锥形瓶中溶液变色后立刻停止滴定,进行读数消耗标准液体积减少,测定结果偏低;
C.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡导致消耗标准液体积减少,测定结果偏低;
D.滴定终点时仰视读数,读数增加,测定结果偏高,答案选BC;
②由反应:2Fe3++2I-=2Fe2++I2、I2+2S2O32-═2I-+S4O62-可得关系式:
2Fe3+—I2—2S2O32-
11
ncV×10-3
则n(Fe3+)=cV×10-3mol,则样品中氯化铁的质量分数为:ω(Fe3+)=cV×10-3mol×10×162.5g/mol×100%=![]() 。
。