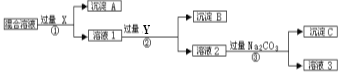
题目内容
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题.
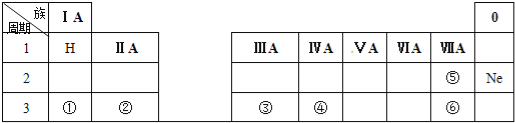
(1)元素④的符号是 ;
(2)⑤和⑥两种元素原子半径的大小关系:⑤ ⑥(填“>”或“<”);
(3)①和②两种元素金属性强弱关系:① ②(填“>”或“<”);
(4)①的最高价氧化物的水化物与元素③的单质反应的化学方程式为: .
【答案】(1)Si(2)<(3)>(4)2NaOH+2Al+2H2O=2NaAlO2+3H2↑
【解析】解:(1)由元素在周期表中位置可知,①为Na、②为Mg、③为Al、④为Si、⑤为F、⑥为Cl,故答案为:Si;
(2)同主族随原子序数增大,原子半径越大,故原子半径F<Cl,故答案为:<;
(3)①为Na、②为Mg,二者处于同一周期,原子序数越大,金属性越弱,则金属性大小为:Na>Mg,故答案为:>;
(4)①的最高价氧化物的水化物NaOH,元素③的单质为Al,Al与NaOH溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2NaOH+2Al+2H2O=2NaAlO2+3H2↑

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
【题目】
(1)需要称量NaOH固体 克;
(2)需量取密度为1.19g/cm3、质量分数为36.5%的浓盐酸________mL;
(3)定容时的操作是:继续向容量瓶中加蒸馏水至 ,改用胶头滴管滴加蒸馏水至 。
(4)配制过程中,下列实验操作导致所配制的稀盐酸的物质的量浓度偏大的有 。
A.量取浓盐酸时发现量筒不干净,用水洗净后直接量取 |
B.用量筒量取浓盐酸时仰视观察凹液面 |
C.稀释浓盐酸时,没有冷却就立即转移到容量瓶中 |
D.定容时俯视刻度线 |
E.加蒸馏水时不慎超过了刻度线,用胶体滴管吸出
F.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水