题目内容
9.高铁电池是一种新型可充电电池,电解液为KOH溶液,放电时的总反应式为:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH下列叙述正确的是( )| A. | 放电时,正极区溶液的pH减小 | |
| B. | 该电用电可用稀H2SO4代替KOH溶液 | |
| C. | 充电时,电解质溶液中的K+等阳离子向Zn电极移动 | |
| D. | 充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
分析 根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为3Zn-6e-+6OH-═3Zn(OH)2,高铁酸钾在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,根据电极反应式可判断电子转移的物质的量与反应物之间的关系,充电时,阳极上氢氧化铁转化成高铁酸钾,电极反应式为Fe(OH)3+5OH-=FeO42+4H2O+3e-,阳极消耗OH-离子,碱性要减弱,以此解答该题.
解答 解:A、正极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,pH增大,故A错误;
B、硫酸能够与Zn反应,所以不能用硫酸代替NaOH,故B错误;
C、充电时,阳离子移向阴极,故C正确;
D、充电时,铁离子失去电子,发生Fe(OH)3转化为FeO42-的反应,电极反应为Fe(OH)3-3e-+5OH-=FeO42-+4H2O,每转移3mol电子,阳极有1mol Fe(OH)3被氧化,故D错误;
故选C.
点评 本题考查电解池与原电池,明确电极反应中放电为原电池、充电为电解池为解答本题的关键,题目难度不大.

练习册系列答案
相关题目
19. 重大节日为保证鲜花盛开,对大量盆栽鲜花施用了S=诱抗素制剂.S-诱抗素的分子结构如图所示.下列关于该物质的说法正确的是( )
重大节日为保证鲜花盛开,对大量盆栽鲜花施用了S=诱抗素制剂.S-诱抗素的分子结构如图所示.下列关于该物质的说法正确的是( )
 重大节日为保证鲜花盛开,对大量盆栽鲜花施用了S=诱抗素制剂.S-诱抗素的分子结构如图所示.下列关于该物质的说法正确的是( )
重大节日为保证鲜花盛开,对大量盆栽鲜花施用了S=诱抗素制剂.S-诱抗素的分子结构如图所示.下列关于该物质的说法正确的是( )| A. | 该有机物的分子式为C15H22O4 | |
| B. | 1mol该有机物与足量Na反应生成1molH2 | |
| C. | 该有机物能发生取代、加成和水解反应 | |
| D. | 1mol该有机物与足量溴反应最多消耗4molBr2 |
20.部分弱电解质的电离平衡常数如下表,以下选项错误的是( )
| 化学式 | NH3•H2O | CH3COOH | HCN | H2CO3 |
| Ki(25℃) | 1.8×l0-5 | 1.8×l0-5 | 4.9×l0-10 | Ki1=4.3×l0-7 Ki2=5.6×l0-11 |
| A. | 等物质的量浓度的NaHCO3和NaCN溶液,前者溶液中水的电离程度大 | |
| B. | 0.1 mol/L CH3COONa 溶液显碱性,0.1 mol/L CH3COONH4 溶液显中性 | |
| C. | CN-+H2O+CO2→HCN+HCO3- | |
| D. | 中和等体积、等pH的CH3COOH和HCN消耗NaOH的量前者小于后者 |
14.某小组为研究原电池原理,设计如图装置,下列叙述正确的是( )


| A. | 若X为Fe,Y为Cu,铁为正极 | |
| B. | 若X为Fe,Y为Cu,电子由铜片流向铁片 | |
| C. | 若X为Fe,Y为C,碳棒上有红色固体析出 | |
| D. | 若X为Cu,Y为Zn,锌片发生还原反应 |
1.用下列实验装置进行相应实验,能达到实验目的是( )


| A. | 用图1所示装置可收集NO气体 | |
| B. | 用图4装置可证明酸性:H2SO4>H2CO3>H2SiO3 | |
| C. | 用图3所示装置可实现反应:2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+H2↑ | |
| D. | 用图2所示装置可吸收多余氨气且能防止倒吸 |
2.下列说法正确的是( )
| A. | 单质硅化学性质稳定,但自然界不存在游离态的硅 | |
| B. | 氨气的水溶液能导电,说明氨气是电解质 | |
| C. | SO2使溴水或品红溶液褪色,体现了SO2的漂白性 | |
| D. | 镁、铝、铜等金属一般采用热还原法冶炼 |
3.某药物中间体的合成路线如下:下列说法正确的是( )
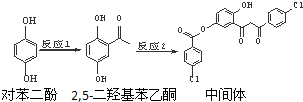

| A. | 对苯二酚和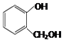 互为同系物 互为同系物 | |
| B. | 1 mol该中间体最多可与7 mol氢氧化钠反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、水解等反应 | |
| D. | 该中间体分子含有羰基和羟基两种含氧官能团 |