题目内容
【题目】已知:pKa=-lgKa,25℃时,H2A 的 pKa1=1.85,pKa2=7.19。常温下,用 0.1 mol/LNaOH 溶液滴定20 mL 0.1 mol/LH2A 溶液的滴定曲线如图所示。下列说法正确的是
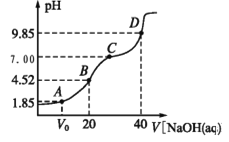
A. A 点所得溶液中:V0<10 mL
B. B 点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C. C 点所得溶液中:c(A2-)= c(Na+)-c(HA-)-c(H2A)
D. D 点所得溶液中 A2-水解平衡常数 Kh1=10-7.19
【答案】A
【解析】
A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,H2A的一级电离平衡常数为Ka1=![]() =10-1.85mol/L,所以c(H+)=Ka1,表明溶液中c(NaHA)=c(H2A),若恰好是10mLNaOH,反应起始时存在c(NaHA)=c(H2A),平衡时c(H2A)<c(NaHA),因此所加NaOH体积需<10mL,会得到平衡时c(NaHA)=c(H2A),即V0<10mL,故A错误;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHA,为第一个滴定终点,溶液中存在质子守恒,c(H2A)+c(H+)=c(A2-)+c(OH-),故B错误;C.C点溶液为NaHA和Na2A,溶液中存在电荷守恒,即2c(A2-)+ c(HA-)+c(OH-)= c(Na+)+c(H+),此时溶液pH=7,则2c(A2-)+ c(HA-)= c(Na+),若c(A2-)= c(Na+)-c(HA-)-c(H2A)成立,即得c(A2-)= c(H2A),显然(A2-)≠ c(H2A),故C错误;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成Na2A,为第二个滴定终点,此时Na2A水解使溶液显碱性,溶液的pH为9.85,发生水解的方程式为A2-+H2OHA-+OH-,则A2-水解平衡常数Khl=
=10-1.85mol/L,所以c(H+)=Ka1,表明溶液中c(NaHA)=c(H2A),若恰好是10mLNaOH,反应起始时存在c(NaHA)=c(H2A),平衡时c(H2A)<c(NaHA),因此所加NaOH体积需<10mL,会得到平衡时c(NaHA)=c(H2A),即V0<10mL,故A错误;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHA,为第一个滴定终点,溶液中存在质子守恒,c(H2A)+c(H+)=c(A2-)+c(OH-),故B错误;C.C点溶液为NaHA和Na2A,溶液中存在电荷守恒,即2c(A2-)+ c(HA-)+c(OH-)= c(Na+)+c(H+),此时溶液pH=7,则2c(A2-)+ c(HA-)= c(Na+),若c(A2-)= c(Na+)-c(HA-)-c(H2A)成立,即得c(A2-)= c(H2A),显然(A2-)≠ c(H2A),故C错误;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成Na2A,为第二个滴定终点,此时Na2A水解使溶液显碱性,溶液的pH为9.85,发生水解的方程式为A2-+H2OHA-+OH-,则A2-水解平衡常数Khl=![]() =
=![]() =
=![]() =10-6.81,故D错误。故答案为A。
=10-6.81,故D错误。故答案为A。