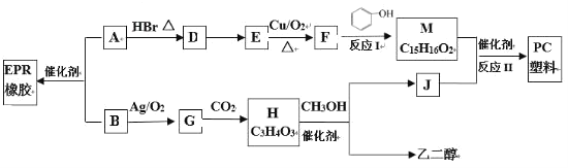
题目内容
【题目】随原子序数的递增,五种短周期元素原子半径与原子序数的关系如图所示。
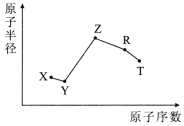
已知:TX2是现代光学及光纤制品的基本原料;ZY 能破坏水的电离平衡;Z3RY6在工业上常用作助熔剂。
(1)R在元素周期表中的位置是___。
(2)上述元素中的某两种元素可组成一种五原子共价化合物,该化合物的电子式为___。
(3)请用一个化学方程式比较X和Y的非金属性的强弱_____。
(4)工业上以Z3RY6作助熔剂的目的是____。
(5)已知11.5gZ的单质在X2中完全燃烧,恢复至室温,放出QkJ热量,该反应的热化学方程式为___。
【答案】第三周期 第IIIA族  或
或
![]() 降低氧化铝熔点,节约冶炼铝的能源
降低氧化铝熔点,节约冶炼铝的能源 ![]()
【解析】
TX2是现代光学及光纤制品的基本原料,则T为Si,X为O,Z3RY6在工业上常用作助熔剂,Z为Na,R为Al,Y为F。
(1)R为Al元素,在元素周期表中的位置是第三周期 第IIIA族;
(2)上述元素中的某两种元素可组成一种五原子共价化合物,则该共价化合物应由一个+4价原子和四个-1价原子构成,如SiF4,也可以是一些比较特殊的物质,如O3F2,故电子式为 或
或 ;
;
(3)可以通过比较单质氧化性的强弱来比较X和Y的非金属性的强弱,方程式为![]() ;
;
(4)工业上以Z3RY6(即Na3AlF6)作电解熔融态氧化铝制备铝单质时的助熔剂,目的是降低氧化铝熔点,节约冶炼铝的能源;
(5)Z的单质在X2中完全燃烧,化学方程式为![]() ,11.5gZ燃烧放出QkJ热量,则2molZ燃烧放出的能量为4QkJ,故热化学方程式为
,11.5gZ燃烧放出QkJ热量,则2molZ燃烧放出的能量为4QkJ,故热化学方程式为![]() 。
。

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目