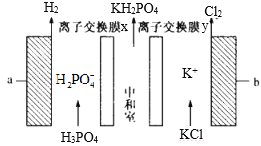
��Ŀ����
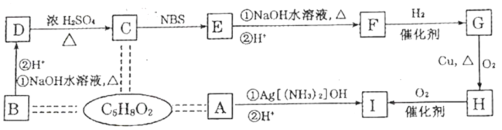
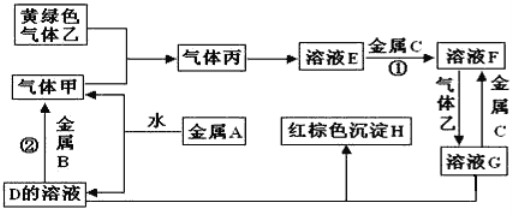
����Ŀ�������ֽ�������A��B��C������A����ɫ��ӦΪ��ɫ��B��C�dz������������ֽ�������A��B��C��������ס��ҡ���������D��E��F��G��H֮�䷢������ת����ϵ(ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û�б��)��
�����������Ϣ�ش���������
(1)д���������ʵĻ�ѧʽ��A__��H ___�� G____����___��
(2)д�����з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ��_______��
��Ӧ��________��
(3)�����ҺG�н������ӵij��÷����ǣ�____��
���𰸡�Na Fe(OH)3 FeCl3 Cl2 2HCl +Fe=FeCl2+H2�� 2Al+2NaOH+2H2O=2NaAlO2+3H2�� ȡG��Һ�������Թ��ڣ���������KSCN��Һ������죬˵��G����Fe3+��������죬˵��G��û��Fe3+��
��������
A�ǽ������ʣ�������ɫ��ӦΪ��ɫ����A��Na������ɫ��������Cl2������ɫ������H��Fe(OH)3��Na��ˮ��Ӧ����NaOH��H2�������H2��D��NaOH������B�ܺ�NaOH��Һ��Ӧ������������B��Al��������������Ӧ����HCl�������HCl��E�����ᣬ�����C��Ӧ����F��F�ܺ�������Ӧ����G��G��NaOH��Ӧ����Fe(OH)3����G��FeCl3��F��FeCl2��C��Fe���ٽ����Ŀ�������
(1)ͨ�����Ϸ���֪��A��Na��H��Fe(OH)3��G��FeCl3������Cl2���ʴ�ΪNa��Fe(OH)3��FeCl3��Cl2��
(2)��Ӧ����Fe������ķ�Ӧ�����仯ѧ����ʽΪ��Fe+2HCl=FeCl2+H2������Ӧ��Ϊ����Al��NaOH��Һ��Ӧ����ƫ�����ƺ������Ĺ��̣����仯ѧ����ʽΪ��2Al+2NaOH+2H2O=2NaAlO2+3H2�����ʴ�ΪFe+2HCl=FeCl2+H2����2Al+2NaOH+2H2O=2NaAlO2+3H2����
(3)��ҺGΪFeCl3������Fe3+�ķ���Ϊ��ȡG��Һ�������Թ��ڣ���������KSCN��Һ������죬˵��G����Fe3+��������죬˵��G��û��Fe3+��

����Ŀ���̸��ǹ�ҵ�Ϸdz���Ҫ��һ �ֺϽ� ����Ҫ�ɷ����������̿�(��Ҫ�ɷ�ΪMnO2������������Al2O3��MgO��SiO2)Ϊԭ���Ʊ��ģ�ij������������������ͼ��ʾ ��
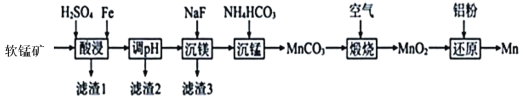
��֪��MnO2������ϡ���ᣬ�������������������º�һЩ��ԭ����Ӧ���� Mn2+��
������ | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
�ܶȻ����� | 4.0��10-38 | 1.0��10-33 | 1.8��10-11 | 1.8��10-13 |
(1)Ϊ������̵Ľ����� ��ͨ����Ҫ�����̿�_______�� ���ʱ MnO2 �ܽ�����ӷ�Ӧ����ʽ��____________________��
(2)���� 2 ����Ҫ�ɷ���____________(�ѧʽ)��
(3)����ʱ��������Ҫ���ӷ�Ӧ����ʽ��________; ���̺���Ҫ�����õij������й��ˡ�ϴ�Ӳ�������μ��������ϴ����________________��
����Ŀ��100��ʱ���ڲ�ͬ�������Ӵ����£��������⾭��24h�ķֽ������±���ʾ��
���� | ��������mg��L��1�� | �ֽ���/% | ���� | ��������mg��L��1�� | �ֽ���/% |
�� |
| 2 | Fe2�� | 1.0 | 15 |
Al3�� | 10 | 2 | Cu2�� | 0.1 | 86 |
Zn2�� | 10 | 10 | Cr3�� | 0.1 | 96 |
�����й�˵����ȷ����
A.��ʹ��������ֽⷴӦ��ܽ�������������Al3��
B.��������ʹƽ���ƶ�����߹�������ķֽ���
C.������������м���ˮ����������ķֽ����ʼӿ�
D.�õ���H2O2��O2ʱ���������ֽ���ȣ�������������KMnO4��Һ�ɵõ�����O2