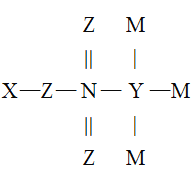��Ŀ����
����Ŀ���¹ڷ��������ڼ䣬���ֺ�����������84����Һ��Cl2��NaClO2�ȶԲ��������кܺõ���ɱ���ã�������������(NaClO2)�ڹ�ҵ�ϳ���ClO2����Ϊԭ���Ʊ���ʵ�����Ʊ��������Ƶ�װ����ͼ��ʾ(�г�װ������)��

��֪���ٿ��Ƶ�ѹ��ⱥ��ʳ��ˮ�ɵõ�ClO2��
��Cl2������CCl4��
�����������ڲ�ͬ�¶��µ��ܽ�����±���ʾ��
�¶ȡ� | 20 | 40 | 60 |
�ܽ��/g | 6.2 | 23.4 | 48.3 |
�ش��������⣺
(1)װ�ü��в���ClO2�ĵ缫��ӦʽΪ_____________________��
(2)װ������CCl4������Ϊ________________________________��
(3)װ�ñ�������NaClO2�Ļ�ѧ����ʽΪ____________________________��
(4)��װ�ñ���Ӧ�����Һ�л��NaClO2����IJ������£�
���в���ټ��ȵ�_________________(������)ʱֹͣ���ȣ��������__________________��
(5)ȷ��ȡ2.26gNaClO2��Ʒ������ʢ��20.00mL����в���ȴ����ˮ������10%��ϡ�����30.00mL��������Ϊ40%��KI��Һ(����)�ĵ���ƿ�У������ܷⲢҡ�ε���ƿ��������ȫ��Ӧ���ټ��������ָʾ����Ũ��Ϊ3.00mol/L��Na2S2O3��Һ�ζ�(��֪���������з����ķ�Ӧ����Ϊ![]() ��4I����4H��=2I2��Cl����2H2O��
��4I����4H��=2I2��Cl����2H2O��![]() )��
)��
��������ƽ��ʵ�������ĵ�Na2S2O3��Һ��ƽ�����Ϊ30.00mL�����Ʒ�Ĵ���Ϊ_________________%(������λ��Ч����)��
����ʹ�õ�ˮδ��У���ⶨ�����___________________(�ƫ�ߡ���ƫ�͡�����Ӱ�족)��
���𰸡�Cl- -5e- + 2H2O = ClO2��+ 4H+ ��ȥClO2�п��ܺ��е�Cl2 2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2 ��Һ������־�Ĥ ��ȴ�ᾧ 90.1 ƫ��
��������
�����⼰װ��ͼ��֪��װ�ü�ͨ�����Ƶ�ѹ��ⱥ��ʳ��ˮ��ȡClO2��ClO2�п��ܺ���Cl2��Cl2��NaOH��Ӧ�����ɴ������ƻ������ƣ���װ���ҵ������dz�ȥCl2����װ�ñ��У��������ԭClO2��ȡNaClO2��װ�ö��������ն����ClO2����ֹ��Ⱦ����������NaClO2���ܽ�����ݿ�֪�����ܽ�����¶ȵı仯���仯���ԣ���˿�ͨ����NaClO2��Һ��������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ�NaClO2���壬�ݴ˷������
(1)װ�ü�ͨ�����Ƶ�ѹ��ⱥ��ʳ��ˮ��ȡClO2����Ԫ�ػ��ϼ����ߣ�����ʧ���ӵ�������Ӧ����װ�ü��в���ClO2�ĵ缫��ӦʽΪCl- - 5e- + 2H2O = ClO2��+ 4H+��
(2)�����Ϸ���֪��װ������CCl4������Ϊ��ȥClO2�п��ܺ��е�Cl2��
(3)װ�ñ��У��������ԭClO2��ȡNaClO2�����ݵ�ʧ�����غ㡢Ԫ���غ���ƽ�÷�Ӧ�Ļ�ѧ����ʽΪ2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2��
(4)����NaClO2���ܽ�����ݿ�֪�����ܽ�����¶ȵı仯���仯���ԣ���˿�ͨ����NaClO2��Һ��������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ�NaClO2���壬��˲���ټ��ȵ���Һ������־�Ĥʱֹͣ���ȣ����������ȴ�ᾧ��
(5)������֪��Ӧ�ɵù�ϵʽ��NaClO2~2I2~4S2O32-����m(NaClO2)=![]() �����Ʒ�Ĵ���Ϊ
�����Ʒ�Ĵ���Ϊ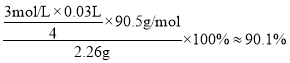 ��
��
����ʹ�õ�ˮδ��У�ˮ�лẬ��������������Ҳ���������������ɵⵥ�ʣ��Ӷ�ʹ���ĵ�Na2S2O3��Һ�����������ⶨ�����ƫ�ߡ�

 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�����Ŀ��100��ʱ���ڲ�ͬ�������Ӵ����£��������⾭��24h�ķֽ������±���ʾ��
���� | ��������mg��L��1�� | �ֽ���/% | ���� | ��������mg��L��1�� | �ֽ���/% |
�� |
| 2 | Fe2�� | 1.0 | 15 |
Al3�� | 10 | 2 | Cu2�� | 0.1 | 86 |
Zn2�� | 10 | 10 | Cr3�� | 0.1 | 96 |
�����й�˵����ȷ����
A.��ʹ��������ֽⷴӦ��ܽ�������������Al3��
B.��������ʹƽ���ƶ�����߹�������ķֽ���
C.������������м���ˮ����������ķֽ����ʼӿ�
D.�õ���H2O2��O2ʱ���������ֽ���ȣ�������������KMnO4��Һ�ɵõ�����O2