题目内容
【题目】下列指定反应的离子方程式不正确的是( )
A. NO2溶于水:3NO2+H2O=2H++2NO3-+NO
B. 漂白粉溶液呈碱性的原因:ClO-+H2O![]() HClO+OH-
HClO+OH-
C. 酸性条件下用H2O2将海带灰中I-氧化:H2O2+2I-+2H+=I2+2H2O
D. 氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
【答案】D
【解析】
A. NO2溶于水生成硝酸与NO,其离子方程式为:3NO2+H2O=2H++2NO3-+NO,A项正确;
B. 漂白粉溶液呈碱性的原因是次氯酸根离子发生水解所致,其离子方程式为:ClO-+H2OHClO+OH-,B项正确;
C. 酸性条件下,用H2O2将海带灰中I-氧化,其离子方程式为:H2O2+2I-+2H+=I2+2H2O,C项正确;
D. 氯化铝的溶液中加入过量氨水,沉淀不会溶解,其正确的离子反应方程式为Al3++3NH3H2O = Al(OH)3↓+3NH4+,D项错误;
答案选D。

【题目】NO2是大气污染物,但只要合理利用也是重要的资源。回答下列问题:
(1)NO2可以被NaOH溶液捕获生成两种钠盐,溶液呈碱性,写出反应的化学方程式______________,已知常温下,HNO2的电离平衡常数为Ka=5.0×10-4,则0.1mo/L NaNO2中c(OH-)=_____________(已知![]() )
)
(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步,反应情况如下表:
2NO2(g)的反应历程分两步,反应情况如下表:
反应 | 速率表达式 | 反应热 |
反应I:2NO(g) |
| △H1<0 |
反应II:N2O2(g)+O2(g) |
| △H2<0 |
反应2NO(g)+O2(g) ![]() 2NO2(g)的△H______(用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H______(用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,若升高温度,K将____(填“增大”、“减小”或“不变”),平衡常数的表达式K=____(用
2NO2(g)达到平衡状态,若升高温度,K将____(填“增大”、“减小”或“不变”),平衡常数的表达式K=____(用![]() 、
、![]() 、
、![]() 、
、![]() 表示)
表示)
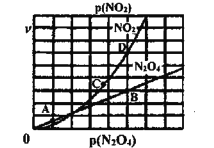
(3)反应N2O4(g) ![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中![]() 、
、![]() 是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
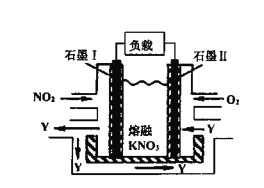
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。Y的化学式为____________




