题目内容
4.常温下,下列有关叙述正确的是( )| A. | 0.1 mol•L-1 pH为4的KHC2O4溶液中:c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中:c(Na+)+c(OH-)>c(H+)+c(F-) | |
| C. | 向0.1mol/L的Na2S溶液中通入H2S至溶液呈中性(忽略体积变化),则溶液中:c(HS-)+2c(S2-)=0.2mol/L | |
| D. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
分析 A、0.1 mol•L-1 pH为4的KHC2O4溶液显酸性,说明酸根离子水解小于电离,c(H2C2O4)<c(C2O42-);
B、HF是弱酸存在电离平衡pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,溶液显酸性c(OH-)<c(H+),c(F-)>c(Na+),结合电荷守恒分析判断;
C、向0.1mol/L的Na2S溶液中通入H2S至溶液呈中性,结合电荷守恒分析;
D、醋酸酸性大于次氯酸,醋酸根离子水解程度小于次氯酸根离子,c(ClO-)<c(CH3COO-);
解答 解:A、0.1 mol•L-1 pH为4的KHC2O4溶液显酸性,说明酸根离子水解小于电离,c(H2C2O4)<c(C2O42-),溶液中:c(HC2O4-)>c(C2O42-)>c(H2C2O4),故A错误;
B、HF是弱酸存在电离平衡pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,溶液显酸性c(OH-)<c(H+),c(F-)>c(Na+),结合电荷守恒分析判断,c(OH-)+c(F-)=c(Na+)+c(H+),c(Na+)+c(OH-)<c(H+)+c(F-),故B错误;
C、向0.1mol/L的Na2S溶液中通入H2S至溶液呈中性,c(OH-)=c(H+),结合电荷守恒分析,c(OH-)+c(HS-)+2c(S2-)=c(H+)+c(Na+),c(HS-)+2c(S2-)=c(Na+)=0.2mol/L,故C正确;
D、醋酸酸性大于次氯酸,醋酸根离子水解程度小于次氯酸根离子,c(ClO-)<c(CH3COO-),各离子浓度的大小关系是:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了电解质溶液中离子浓度大小,溶液中电荷守恒分析判断,盐类水解的实质分析,掌握基础是关键,题目难度中等.

| A. | 拉瓦锡 | B. | 道尔顿 | C. | 阿伏加德罗 | D. | 门捷列夫 |
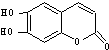 具有抗菌作用.1mol该物质与足量的NaOH溶液反应,消耗NaOH的物质的量是( )
具有抗菌作用.1mol该物质与足量的NaOH溶液反应,消耗NaOH的物质的量是( )| A. | 1mol | B. | 2 mol | C. | 3 mol | D. | 4 mol |
| A. | υ(A)=0.3 mol/(L•min) | B. | υ(B)=0.6 mol/(L•min) | ||
| C. | υ(C)=0.5 mol/(L•min) | D. | υ(A)=0.01 mol/(L•s) |
| A. | 室温时,1L pH=2的NH4Cl溶液中水电离出10-12 molH+ | |
| B. | 常温常压下,46g NO2含有的原子数等于3NA | |
| C. | 12g石墨含有4NA个自由移动的电子 | |
| D. | 22.4LCl2与足量NaOH反应,转移电子数NA |
| A. | 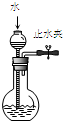 图1所示装置可检查装置气密性 | |
| B. | 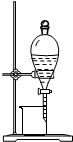 图2所示装置可从碘的CCl4溶液中分离出碘 | |
| C. | 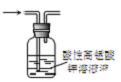 图3所示装置可除去甲烷中乙烯 | |
| D. | 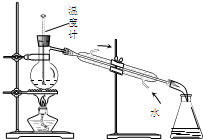 图4所示装置可分离甲苯与乙醇 |
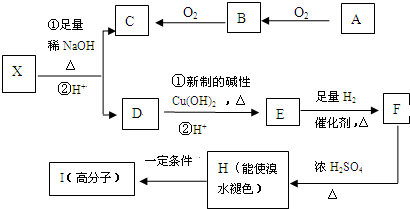
 ;
;
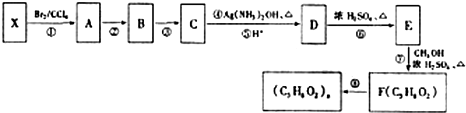
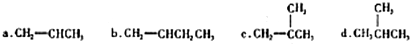
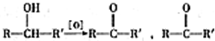 不易被氧化成羧酸
不易被氧化成羧酸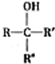 不易被氧化成醛或酮
不易被氧化成醛或酮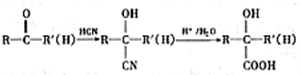
 .
.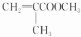 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$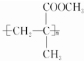 .
.
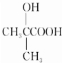
 (R、R′代表烃基)
(R、R′代表烃基)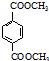 有多种同分异构体,同时满足下列条件的同分异构体有8种.
有多种同分异构体,同时满足下列条件的同分异构体有8种. .
.