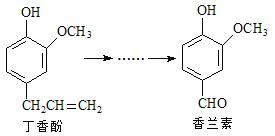
题目内容
【题目】(物质结构与性质)
硅电池、锂离子电池都是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(l) LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的立体构型为____。P、O、S的电负性从大到小的顺序为______________
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸 常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗坏血酸中碳原子的杂化方式为 ___,1mol抗坏血酸中手性碳原子的数目为______。(取材于选修3课本51页)。
常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗坏血酸中碳原子的杂化方式为 ___,1mol抗坏血酸中手性碳原子的数目为______。(取材于选修3课本51页)。
(3) Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是____(填标号)。
A.![]() B.
B. C.
C.![]() D.
D.
(4)目前最常用的电极材料有锂钴复合氧化物和石墨。
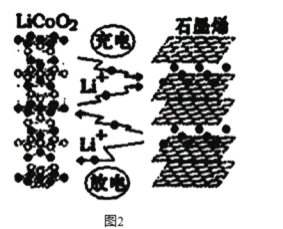
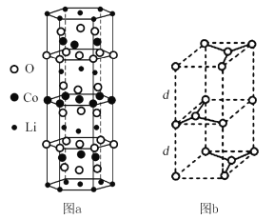
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li-O-Co-O-Li–O-Co-O- Li--顺序排列,则该化合物的化学式为____,Co3+的价层电子排布式为_____。
②石墨晶胞(图b)层间距为d pm,C—C键长为a pm,石墨晶体的密度为p g/cm3,列式表示阿伏加德罗常数为____mol-l。
(5)硅酸盐中Si元素一般显+4价,如下图所示是一种无限长单键的多聚硅酸根离子的结构,其中“![]() ”表示Si原子,“
”表示Si原子,“![]() ”表示氧原子,则该长链硅酸根离子的通式为________________________。
”表示氧原子,则该长链硅酸根离子的通式为________________________。

【答案】正四面体 O>S>P 分子中含有多个羟基,可与水分子间形成氢键 sp2、sp3 2NA B LiCoO2 3d6 ![]() (SinO3n+1)(2n+2)-
(SinO3n+1)(2n+2)-
【解析】
(1)PO43-中P原子价层电子对个数![]() =4,且不含孤电子对,根据价层电子对互斥理论判断空间构型;元素的非金属性越强,其电负性越大;
=4,且不含孤电子对,根据价层电子对互斥理论判断空间构型;元素的非金属性越强,其电负性越大;
(2)根据抗坏血酸分子内含基,可与水分子间形成氢键判断;根据分子内有碳原子连接方式判断杂化方式;与四个不同的原子或原子团相连的碳原子称为手性碳原子;
(3)结合信息:O2因具有单电子而成为顺磁性分子,从示意图知B结构中化学键有3电子,B有单电子;
(4)①根据结构示意图判断Li、Co和O个数比,进而得到化学式;钴的原子序数为27,Co3+有24个电子,电子排布式为[Ar]3d6;
②计算石墨晶胞中碳原子数目,进而求出晶胞的质量,根据图中信息求出晶胞的体积,应用晶胞的密度![]() 进行求算;
进行求算;
(5)根据图示找出规律,然后推断硅原子数目为n时含有的氧原子数目及所带电荷数,从而确定其化学式。
(1)PO43-中P原子价层电子对个数![]() =4,且不含孤电子对,根据价层电子对互斥理论判断空间构型为正四面体结构;元素的非金属性越强,其电负性越大,则电负性O>S>P;故答案为:正四面体;O>S>P;
=4,且不含孤电子对,根据价层电子对互斥理论判断空间构型为正四面体结构;元素的非金属性越强,其电负性越大,则电负性O>S>P;故答案为:正四面体;O>S>P;
(2)抗坏血酸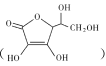 碳原子数目相对较少,但分子内含4个羟基,可与水分子间形成氢键,因此它易溶于水;分子内有碳碳单键、对应碳原子sp3杂化方式,也有碳碳双键,对应碳原子sp2杂化方式;与四个不同的原子或原子团相连的碳原子称为手性碳原子,由图知,1个抗坏血酸分子中含2个手性碳原子,则1mol抗坏血酸中手性碳原子的数目为2NA;故答案为:分子中含有多个羟基,可与水分子间形成氢键;sp3、sp2;2NA;
碳原子数目相对较少,但分子内含4个羟基,可与水分子间形成氢键,因此它易溶于水;分子内有碳碳单键、对应碳原子sp3杂化方式,也有碳碳双键,对应碳原子sp2杂化方式;与四个不同的原子或原子团相连的碳原子称为手性碳原子,由图知,1个抗坏血酸分子中含2个手性碳原子,则1mol抗坏血酸中手性碳原子的数目为2NA;故答案为:分子中含有多个羟基,可与水分子间形成氢键;sp3、sp2;2NA;
(3)结合信息:O2因具有单电子而成为顺磁性分子,从示意图知B结构中化学键有3电子,B有单电子,B满足;故答案为:B;
(4)①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),整个六棱柱结构中:Li个数为:12×![]() +2×
+2×![]() +6=9个,Co个数为:7+6×
+6=9个,Co个数为:7+6×![]() =9,O个数为14+12×
=9,O个数为14+12×![]() =18,则,Li、Co和O个数比为1:1:2,化学式为 LiCoO2;钴的原子序数为27,Co3+有24个电子,电子排布式为[Ar]3d6,其价层电子排布式为3d6;故答案为:LiCoO2;3d6;
=18,则,Li、Co和O个数比为1:1:2,化学式为 LiCoO2;钴的原子序数为27,Co3+有24个电子,电子排布式为[Ar]3d6,其价层电子排布式为3d6;故答案为:LiCoO2;3d6;
②石墨晶胞中碳原子数目=8×![]() +4×
+4×![]() +1+2=4,故晶胞的质量=4×
+1+2=4,故晶胞的质量=4×![]() g,层内(平行四边形)C-C键长为apm=a×10-10cm,底面的边长为2×
g,层内(平行四边形)C-C键长为apm=a×10-10cm,底面的边长为2×![]() a×10-10cm=
a×10-10cm=![]() a×10-10cm,底面上的高为
a×10-10cm,底面上的高为![]() ×底面的边长=
×底面的边长=![]() a×10-10cm,层间距为dpm,则晶胞的体积=
a×10-10cm,层间距为dpm,则晶胞的体积=![]() a×10-10cm×
a×10-10cm×![]() a×10-10cm×2d×10-10cm=
a×10-10cm×2d×10-10cm=![]() da2×10-30cm3,则该晶胞的密度
da2×10-30cm3,则该晶胞的密度![]() =
=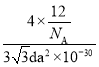 g/cm3,则NA=
g/cm3,则NA=![]() ,故答案为:
,故答案为:![]() ;
;
(5)该长链硅酸根离子每个单元为四面体结构,根据图示可知:若一个单环状离子中Si原子数为n,则含有n个四面体结构,含有的氧原子数为(3n+1)个,即:含有n个Si,则含有(3n+1)个O,带有的负电荷为:n×(+4)+(3n+1) ×(-2)=(2n+2),则其化学式为:(SinO3n+1)(2n+2),故答案为:(SinO3n+1)(2n+2)。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案