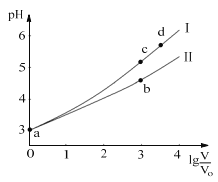
题目内容
【题目】研究人员研制出一种新型储备电源-锂水电池(结构如图,高硅铸铁为惰性辅助电极),使用时加入水即可放电。下列关于该电池工作时的说法正确的是
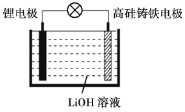
A.高硅铸铁发生氧化反应B.OH-向高硅铸铁电极移动
C.负极的电极反应式为Li-e-=Li+D.电流的方向:锂电极→导线→高硅铸铁电极
【答案】C
【解析】
锂水电池(结构如图,高硅铸铁为惰性辅助电极),根据原电池反应原理,较活泼电极为负极,即锂电极为负极,发生氧化反应,正极为高硅铸铁,发生还原反应。
A. 高硅铸铁为正极,发生还原反应,A错误;
B. 高硅铸铁电极为正极,发生Li+ 的还原反应,电子从锂电极向高硅铸铁电极移动,OH-带负电荷,向锂电极移动,B错误;
C. 负极是锂电极发生氧化反应,电极反应式为Li-e-=Li+ ,C正确;
D. 电流的方向从正极指向负极,高硅铸铁电极→导线→锂电极,D错误。
答案为C。

【题目】以方铅矿(PbS)为原料制备铅蓄电池的电极材料的工艺流程如图所示: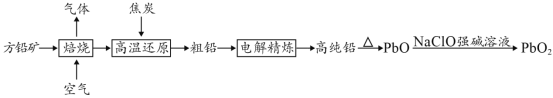
请回答下列问题:
(1)“焙烧”生成的气体直接排放可能造成的环境问题是____________,“焙烧”前须将方铅矿研磨粉粹的目的是________________________________。
(2)电解时,如c(Pb2+)远大于c(H+),则Pb2+优先于H+放电,工业上应用此原理可对铅进行电解精炼。“粗铅”的杂质主要有锌、铁、铜、银等,则阳极泥的主要成分为_________。
(3)写出制备PbO2的离子方程式________________________。
(4)已知部分含铅化合物的Ksp如下表所示:
物质 | PbCl2 | PbS |
Ksp | 1.2×10-5 | 9.0×10-29 |
①铅与稀盐酸反应产生少量气泡后反应终止,原因是_____________________。
②Pb(NO3)2是强酸弱碱盐,氢硫酸是弱酸[Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15],已知K>105时可以认为反应基本完全,通过计算判断向Pb(NO3)2溶液中通入H2S气体能否形成PbS沉淀___________________。(要求写出计算过程)
【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法,氨还可以进一步用来合成尿素、生产纯碱。
(1)写出氨分子的电子式______,其中氮原子有_____种能量不同的电子,氮原子的轨道表示式__________。
(2)根据如图提供的信息,写出该反应的热化学方程式___________________,右图的曲线中______(填“a”或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
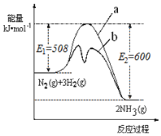
(3)在恒容容器中,下列描述中能说明上述反应已达平衡的是______。
A 3v(H2)正=2v(NH3)逆
B 单位时间内生成nmolN2的同时生成2nmolNH3
C 容器内气体的密度不随时间的变化而变化
D 容器内压强不随时间的变化而变化
(4)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n(N2)/n(H2) | P(MPa) |
1 | 450 | 1/3 | 1 |
2 | ________ | 1/3 | 10 |
3 | 480 | _________ | 10 |
(5)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。图为合成塔中不同氨碳比a
CO(NH2)2(l)+H2O(g)。图为合成塔中不同氨碳比a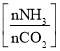 和水碳比b
和水碳比b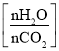 时二氧化碳转化率(α)。b宜控制在_______(填字母)范围内。
时二氧化碳转化率(α)。b宜控制在_______(填字母)范围内。
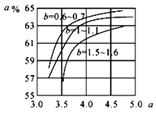
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.6 D. 1~1.6
a宜控制在4.0左右,理由是_________。