题目内容
13.下列各组物质中,互为同分异构体的是( )| A. | CH3-CH2-CH2-CH2-CH3和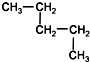 | B. | 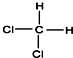 和 和 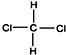 | ||
| C. | CH3-CH3和CH3-CH2-CH3 | D. | 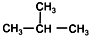 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
分析 同分异构体是指分子式相同,但结构不同的化合物,同分异构体包含碳链异构、官能团异构、位置异构等,以此来解答.
解答 解:A、CH3-CH2-CH2-CH2-CH3和 的分子式都为C5H12,且结构也相同,是同种物质,不是同分异构体,故A错误;
的分子式都为C5H12,且结构也相同,是同种物质,不是同分异构体,故A错误;
B、 和
和  的分子式都为CH2Cl2,由于两者是四面体结构,结构相同,是同种物质,不是同分异构体,故B错误;
的分子式都为CH2Cl2,由于两者是四面体结构,结构相同,是同种物质,不是同分异构体,故B错误;
C、CH3-CH3和CH3-CH2-CH3的分子式不同,不是同分异构体,故C错误.
D、 和CH3-CH2-CH2-CH3的分子式为C4H10,结构不同,是同分异构体,故D正确;
和CH3-CH2-CH2-CH3的分子式为C4H10,结构不同,是同分异构体,故D正确;
故选D.
点评 本题考查了同分异构体的判断,难度不大,注意根据结构简式确定分子式.

练习册系列答案
相关题目
3.将3.48g四氧化三铁完全溶解在100mL 1mol•L-1 的硫酸中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度是( )
| A. | 0.05mol•L-1 | B. | 0.1mol•L-1 | C. | 0.2mol•L-1 | D. | 0.3mol•L-1 |
4.等质量的铜片,在酒精灯上加热后,分别插入下列溶液中,放置片刻后取出,铜片质量比加热前增加的是( )
| A. | 硝酸 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |
1.氯气跟碘在加热条件下,以等物质的量进行反应,可得到一种红棕色液体ICl.ICl有很强的氧化性,ICl跟Zn、H2O反应的化学方程式为:2ICl+2Zn=ZnCl2+ZnI2、ICl+H2O=HCl+HIO,下列叙述中正确的是( )
| A. | ZnCl2既是氧化产物,又是还原产物 | |
| B. | ICl跟H2O的反应是自身氧化还原反应 | |
| C. | ZnI2既是氧化产物,又是还原产物 | |
| D. | 在ICl跟H2O的反应中,ICl是氧化剂,H2O是还原剂 |
8.将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为2.24L.将反应后的固体残渣与过量的稀盐酸反应,又生成3.36L的CO2.(以上或以下气体体积均为标准状况时的体积),下列判断正确的是( )
| A. | 原固体混合物中NaHCO3的物质的量为0.2mol | |
| B. | 固体残渣的成分为NaOH和Na2CO3的混合物 | |
| C. | 原固体混合物中NaOH和NaHCO3的物质的量之比为2﹕5 | |
| D. | 原固体混合物中加入过量盐酸会放出5.6L气体 |
5.某元素R原子最外层电子数为电子总数的$\frac{1}{3}$,该元素的氧化物可能是( )
| A. | R2O | B. | R2O2 | C. | RO2 | D. | R2O5 |
3. 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:
A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和如图所示.下列说法正确的是( )
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和如图所示.下列说法正确的是( )
| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 1.5 mol | 0.5 mol | -- |
| A. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| B. | 上述方程式中a=-160 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大 |


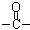 )外,含有的官能团名称是碳碳双键、酯基;
)外,含有的官能团名称是碳碳双键、酯基; .
.