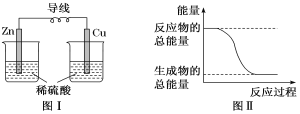
题目内容
【题目】将4molSO2和2mol O2在2L的恒容密闭容器中混合,并在一定条件下发生如下反应: 2SO2(g)+ O2(g)![]() 2SO3(g),若经2s后测得SO3的浓度为0.6mol/L。下列说法中不正确的是
2SO3(g),若经2s后测得SO3的浓度为0.6mol/L。下列说法中不正确的是
A. 用SO2表示反应的平均速率为0.3mol/( L·s)
B. 用O2表示反应的平均速率为0.15mol/(L.s)
C. 2s时O2的浓度为0.7mol/L
D. 2s时SO2的转化率为70%
【答案】D
【解析】
2SO2(g)+ O2(g)![]() 2SO3(g)
2SO3(g)
起始: 4 2 0
变化: 1.2 0.6 2L×0.6mol·L-1
平衡: 2.8 1.4 1.2 根据化学反应速率的定义、转化率的定义进行分析;
2SO2(g)+ O2(g)![]() 2SO3(g)
2SO3(g)
起始: 4 2 0
变化: 1.2 0.6 2L×0.6mol·L-1
平衡: 2.8 1.4 1.2
A、根据化学反应速率的定义,v(SO2)=1.2mol/(2L·2s)=0.3mol/(L·s),故A说法正确;
B、根据化学反应速率的定义,v(O2)=0.6mol/(2L·2s)=0.15mol/(L·s),故B说法正确;
C、2s时O2的浓度为1.4mol/2L=0.7mol·L-1,故C说法正确;
D、SO2的转化率为1.2/4×100%=30%,故D说法错误。

【题目】387℃时,在甲、乙两个体积均为1.0L的恒容密闭容器中发生甲醇合成二甲醚的反应:2CH3OH(g)![]() CH3OCH3(g) + H2O(g),起始时、平衡时各物质的物质的量如下表所示。
CH3OCH3(g) + H2O(g),起始时、平衡时各物质的物质的量如下表所示。
容器 | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | |
甲 | 0.20 | 0.080 | 0.080 |
乙 | 0.40 | a | a |
则:(1)表中a=________。
(2)若起始时向甲容器中充入0.20mol CH3OH(g)、0.50mol CH3OCH3和0.10molH2O(g),则反应达平衡时容器中CH3OH(g)的浓度为多少?_______(写出解题过程)
【题目】现有部分元素的性质与原子(或分子)结构的相关信息如表所示:
元素编号 | 元素性质与原子(或分子)结构的相关信息 |
T | 最外层电子数是次外层电子数的 3 倍 |
X | 常温下单质分子为双原子分子,分子中含有 3 对共用电子对 |
Y | M 层比K 层少 1 个电子 |
Z | 其离子是第三周期金属元素的离子中半径最小的 |
(1)T、X、Y、Z 形成的简单离子半径由大到小的顺序是_____。(用离子符号表示)
(2)元素 Y 与元素 Z 相比,金属性较强的是_____(用元素符号表示),下列表述中能 证明这一事实的是_____(填字母序号)。
a.Y 单质的熔点比 Z 单质的低
b.Y 的化合价比Z 的低
c.常温下Y 单质与水反应的程度很剧烈,而Z 单质在加热条件下才能与水反应
d.Y 最高价氧化物对应的水化物的碱性比 Z 的强
(3)T、X、Y、Z 中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的电子式:________,元素 X 与氢元素以原子个数比 1∶2 化合形成常用于火箭燃料的化合物 W,写出 W 的电子式_______
(4)元素 T 和氢元素以原子个数比 1∶1 化合形成化合物 Q, Q 能与 W 发生氧化还原反应, 生成X 的单质和T 的另一种氢化物,写出该反应的化学方程式:_______