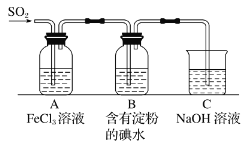
题目内容
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据如图所示,回答下列问题:

(1)Y的化学式为__________________
(2)气体X和气体Y混合产生淡黄色的烟,写出该反应的化学方程式________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是______(填序号)。
a.Na2S +S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
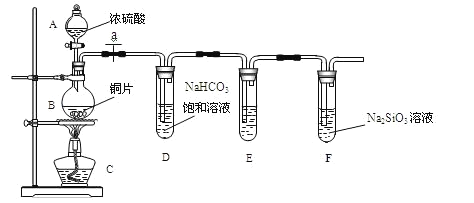
(4)如图为铜丝与W的浓溶液反应并验证其产物性质的实验装置。

①反应①中体现的浓硫酸的化学性质是________。想要立即终止①的反应,最恰当的方法是__________。
a.上移铜丝,使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液
②装置④中品红溶液的作用是________,棉花团的作用__________。
③反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式__________。
【答案】SO2 SO2+2H2S=3S+2H2O b 强氧化性、酸性 a 验证SO2具有漂白性 吸收SO2尾气 SO2+Cl2+2H2O=4H++2Cl-+SO42-、Ba2++SO42-=BaSO4↓
【解析】
根据图示中硫元素的化合价和物质类别,可判断出X为H2S,Y为SO2,W为H2SO4,Z为Na2SO3。
(4)铜丝和浓硫酸反应,生成的二氧化硫进入饱和亚硫酸氢钠溶液中,除去可能挥发的硫酸蒸气,然后进入BaCl2溶液,SO2和BaCl2溶液不发生反应,但SO2易溶于水,所以在BaCl2溶液中会有一定量的SO2以及SO2和水反应生成的H2SO3。SO2进入品红溶液,可以使品红褪色。SO2有毒,不能随意排放,所以最后用浸有NaOH溶液的棉花团吸收多余的SO2。
(1)Y是硫的氧化物,其中硫是+4价,所以Y是SO2。
(2)气体X是H2S,和气体Y(SO2)混合产生淡黄色的烟,两者发生反应生成了淡黄色的单质硫,该反应的化学方程式为SO2+2H2S=3S+2H2O。
(3)欲制备Na2S2O3,从氧化还原角度分析,Na2S2O3中硫是+3价。
a.Na2S中硫是-2价,S单质中硫是0价,都低于+3价,所以不能生成Na2S2O3;
b.Na2SO3中硫是+4价,S单质中硫是0价,可以归中生成Na2S2O3;
c.Na2SO3中硫是+4价,Na2SO4中硫是+6价,都高于+3价,所以不能生成Na2S2O3;
d.SO2中硫是+4价,Na2SO4中硫是+6价,都高于+3价,所以不能生成Na2S2O3;
故选b。
(4) ①反应①是铜和浓硫酸的反应:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,在反应中浓硫酸里的+6价的硫部分变成了+4价,体现了强氧化性,另一部分化合价没有改变,仍为+6价,生成了硫酸盐,体现了酸性,所以反应①中浓硫酸既体现了强氧化性,又体现了酸性。想要立即终止①的反应,最恰当的方法是上移铜丝,使其脱离溶液,故选a。
CuSO4+SO2↑+2H2O,在反应中浓硫酸里的+6价的硫部分变成了+4价,体现了强氧化性,另一部分化合价没有改变,仍为+6价,生成了硫酸盐,体现了酸性,所以反应①中浓硫酸既体现了强氧化性,又体现了酸性。想要立即终止①的反应,最恰当的方法是上移铜丝,使其脱离溶液,故选a。
②SO2有漂白性,可以使品红褪色,所以装置④中品红溶液的作用是验证SO2具有漂白性。SO2有毒,不能随意排放,SO2是酸性氧化物,可以跟NaOH溶液反应,所以浸有NaOH溶液的棉花团的作用吸收SO2尾气。
③反应停止后,待装置冷却,把③取下后向其中加入氯水,氯水能氧化溶液中的SO2以及SO2和水反应生成的H2SO3,生成SO42-,SO42-和Ba2+生成BaSO4白色沉淀,相关反应的离子方程式为:SO2+Cl2+2H2O=4H++2Cl-+SO42-、Ba2++SO42-=BaSO4↓。

【题目】合成氨工业是贵州省开磷集团的重要支柱产业之一。氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g)。该可逆反应达到平衡的标志是___。
2NH3(g)。该可逆反应达到平衡的标志是___。
a.3v正(H2)=2v逆(NH3)
b.单位时间生成mmolN2的同时生成3mmolH2
c.容器内的总压强不再随时间而变化
d.混合气体的密度不再随时间变化
(2)工业上可用天然气原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的
原理,在一定温度下,体积为2L的恒容密闭容器中测得如下表所示数据。请回答下列问题:
时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
10 | 0.21 | 0.81 | 0.19 | 0.64 |
①写出工业用天然气原料制取氢气的化学方程式:___。
②分析表中数据,判断5min时反应是否处于平衡状态?___(填“是”或“否”),前5min反应的平均反应速率v(CH4)=___。
③反应在7~10min内,CO的物质的量减少的原因可能是___ (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
【题目】红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、Mg0少量MnO2等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属钰并制得绿色高效的水处理剂(K2FeO4)。工业流程如下:

(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,写出该反应的离子方程式:________。
(2)浸出液中的阳离子除H+、Fe2+、Fe3+外还有_______(填离子符号)。
(3)已知:不同金属离子生成生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 9.6 | 9.8 | 11.1 |
步骤②中调节溶液的pH等于6,调节pH的试剂最好选用下列哪种试剂:_______(填选项字母,下同)滤渣B除掉杂质后可进一步制取K2FeO4,除掉滤渣B中杂质最好选用下列哪种试剂:_____。
a.稀盐酸 b.KOH c.氨水 d.MnCO3 e.CaCO3
(4)滤渣B经反应④生成高效水处理剂的离子方程式_______________。
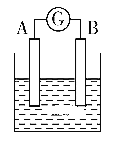
(5)电解装置如图所示,箭头表示溶液中阴离子移动的方向;则与A电极连接的是直流电源的_____极。阳极电解液是稀硫酸,若阴极上只有锰单质析出,当生成11g锰时,另一个电极上产生的气体在标准状况下的体积为________。