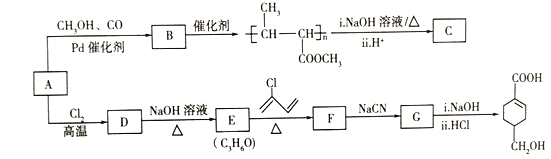
题目内容
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A.将1 L 2 mol·L-1的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA
B.标准状况下,2.24L的H2O中氢原子数目大于2NA
C.1 L 0.1 mol/L NaHSO4溶液中含有0.1 NA个HSO4-
D.78gNa2O2与过量的CO2充分反应转移电子数目为2NA
【答案】B
【解析】
A.将1 L 2 mol·L-1的FeCl3溶液制成胶体后,每个胶体粒子是许多分子或离子的集合体,其中含有氢氧化铁胶粒数小于2NA,故A错误;
B.标准状况下,2.24L的H2O的物质的量=![]() mol,氢原子数目大于2NA,故B正确;
mol,氢原子数目大于2NA,故B正确;
C.硫酸是强酸,HSO4-会继续电离成H+和SO42-,故C错误;
D.Na2O2与CO2反应时Na2O2既是氧化剂、又是还原剂,1molNa2O2参与反应转移1mol电子,78gNa2O2物质的量为1mol,与过量的CO2充分反应转移电子数目为NA,故D错误;
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】雾霾天气严重影响人们的生活和健康。因此采取改善能源结构、机动车限号等措施来减少PM2.5、SO2、NOx等污染。请回答下列问题:
Ⅰ. 臭氧是理想的烟气脱硝剂,其脱硝的反应之一为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生该反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生该反应,相关信息如下表及图所示,回答下列问题:
容器 | 甲 | 乙 |
容积/L | 1 | 1 |
温度/K | T1 | T2 |
起始充入量 | 1molO3和2molNO2 | 1molO3和2molNO2 |
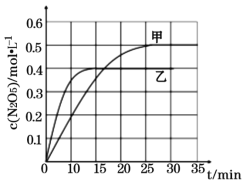
①0~15min内乙容器中反应的平均速率:v(NO2) =____(计算结果保留两位小数)。
②该反应的正反应为____(填“吸热”或“放热”)反应。
③T1时平衡后,向恒容容器中再充入1molO3和2molNO2,再次平衡后,NO2的百分含量将____(填“增大”“减小”或“不变”)。
④反应体系在温度为T1时的平衡常数为____。
⑤在恒温恒容条件下,下列条件不能证明该反应已经达到平衡的是____。
a.容器内混合气体压强不再改变
b.消耗2n molNO2的同时,消耗了n molO3
c.混合气体的平均相对分子质量不再改变
d.混合气体密度不再改变
II. 某化学小组查阅资料后得知:2NO(g)+O2(g) ![]() 2NO2(g) 的反应历程分两步:
2NO2(g) 的反应历程分两步:
①2NO(g)=N2O2(g) (快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2)
②N2O2(g)+O2(g)=2NO2(g) (慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2)
请回答下列问题:
(1)已知决定2NO(g)+O2(g) ![]() 2NO2(g)反应速率的是反应②,则反应①的活化能E1与反应②的活化能E2的大小关系为E1____E2(填“>”“<”或“=”)。
2NO2(g)反应速率的是反应②,则反应①的活化能E1与反应②的活化能E2的大小关系为E1____E2(填“>”“<”或“=”)。
(2)一定温度下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=____。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=____。