题目内容
【题目】叠氮化钠(NaN3)是汽车安全气囊的主要成分,实验室制取叠氮化钠的实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
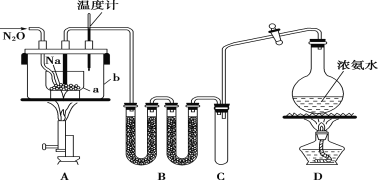
(1)装置B中盛放的药品为____。
(2)步骤①中先加热通氨气一段时间的目的是____;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为____。步骤③中最适宜的加热方式为___(填“水浴加热”,“油浴加热”)。
(3)生成NaN3的化学方程式为____。
(4)产率计算
①称取2.0 g叠氮化钠试样,配成100 mL溶液,并量取10.00 mL溶液于锥形瓶中。
②用滴定管加入0.10 mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质均不参与反应)。
③充分反应后滴入2滴邻菲罗啉指示液,并用0.10 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00 mL(滴定原理:Ce4++Fe2+=Ce3++Fe3+)。计算可知叠氮化钠的质量分数为____(保留2位有效数字)。若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是____(填字母代号)。
A.锥形瓶使用叠氮化钠溶液润洗
B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数
C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内
(5)叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进行销毁,反应后溶液碱性明显增强,且产生无色无味的无毒气体,试写出反应的离子方程式____。
【答案】碱石灰(或生石灰、氢氧化钠固体) 排尽装置中的空气 2Na+2NH3![]() 2NaNH2+H2 油浴加热 NaNH2+N2O
2NaNH2+H2 油浴加热 NaNH2+N2O ![]() NaN3+H2O 65% AC ClO-+2N3-+H2O=Cl-+2OH-+3N2↑
NaN3+H2O 65% AC ClO-+2N3-+H2O=Cl-+2OH-+3N2↑
【解析】
(1)制备的氨气中含有大量的水,B中盛放碱石灰干燥氨气,
故答案为:碱石灰(或生石灰、氢氧化钠固体);
(2)用氨气排尽装置中的空气,防止加热时空气中的氧气等能与钠反应,步骤②制备NaNH2,还生成氢气,反应方程式为:2Na+2NH3![]() 2NaNH2+H2;控制温度210220℃,故选用油浴加热,
2NaNH2+H2;控制温度210220℃,故选用油浴加热,
故答案为:排尽装置中的空气;2Na+2NH3![]() 2NaNH2+H2;油浴加热;
2NaNH2+H2;油浴加热;
(3) NaNH2和N2O在210220℃下反应生成NaN3和水,反应为:NaNH2+N2O ![]() NaN3+H2O,
NaN3+H2O,
故答案为:NaNH2+N2O ![]() NaN3+H2O;
NaN3+H2O;
(4)Ce4+的物质的量浓度总计为0.10 molL1×0.04 L=0.004 mol,分别与Fe2+和N3反应。其中与Fe2+按1:1反应消耗0.10 molL1×0.02 L=0.002 mol,则与N3按1:1反应也为0.002 mol,即10 mL所取溶液中有0.002 mol N3,原2.0 g叠氮化钠试样,配成100 mL溶液中有0.02 mol即1.3 g NaN3,所以样品质量分数为![]() =65%;
=65%;
A. 使用叠氮化钠溶液润洗锥形瓶,使进入锥形瓶中溶质比所取溶液更多,滴定消耗的硫酸亚铁铵标准液体积减小,叠氮化钠溶液浓度偏大,故A正确;
B. 六硝酸铈铵溶液实际取量大于40.00 mL,滴定消耗的硫酸亚铁铵标准液体积增大,计算叠氮化钠溶液浓度偏小,故B错误;
C. 滴定前无气泡,终点时出现气泡,则读数体积为实际溶液体积减气泡体积,硫酸亚铁铵标准液读数体积减小,叠氮化钠溶液浓度偏大,故C正确;
D选项,滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内无影响,故D错误;
故答案为:65%;AC;
(5)反应后溶液碱性明显增强,且产生无色无味的无毒气体,根据氧化还原反应得失电子守恒,则发生的离子反应为:ClO-+2N3-+H2O=Cl-+2OH-+3N2↑
故答案为:ClO-+2N3-+H2O=Cl-+2OH-+3N2↑。

【题目】将浓度均为0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
(资料)
该“碘钟实验”的总反应:H2O2 +2S2O32-+2H+=S4O62-+2H2O
反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是______。对于总反应,I-的作用相当于______。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是______。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液 (含淀粉) | H2O |
实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
实验Ⅲ | 5 | 2 | x | y | z |
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30 min、实验Ⅲ是40 min。
①实验Ⅲ中,x、y、z所对应的数值分别是______。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是______。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。
(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液(含淀粉) | H2O |
实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:_____________________。




