题目内容
13.下列关于强、弱电解质的叙述,正确的是( )| A. | 浓硫酸是强电解质 | |
| B. | 弱电解质在水溶液中一定不能完全电离 | |
| C. | 强电解质的水溶液中不存在分子 | |
| D. | 弱电解质溶液的导电能力一定很弱 |
分析 强电解质和弱电解质均属于电解质,故均为化合物.
强电解质是在水溶液中或熔融状态下能完全电离的电解质,无电解质分子存在;
弱电解质是在水溶液中和熔融状态下不能完全电离的电解质,有未电离的电解质分子存在,据此分析.
解答 解:A、强电解质和弱电解质均属于电解质,故均为化合物,而浓硫酸是混合物,既不是强电解质也不是弱电解质,故A错误;
B、弱电解质在水溶液中和熔融状态下均不能完全电离,故B正确;
C、强电解质本身能完全电离,在其水溶液中无强电解质分子存在,但还有水分子,故C错误;
D、强弱电解质的区别在于能否完全电离,与溶液的导电能力无关,即弱电解质的导电能力不一定弱,故D错误.
故选B.
点评 本题考查了强弱电解质的区别,应注意的是强弱电解质的区别在于能否完全电离,与导电能力和溶解度无关.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
4.NaHSO4在水溶液中能电离出H+、Na+、和SO42-,下列对于NaHSO4的分类不正确的是( )
| A. | NaHSO4是盐 | B. | NaHSO4是一元酸 | C. | NaHSO4是钠盐 | D. | NaHSO4是酸式盐 |
8.在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O下列叙述中正确的是( )
| A. | 反应中KMnO4被氧化 | |
| B. | HCl发生还原反应 | |
| C. | 每生成1 mol Cl2时,反应中转移的电子为2 mol | |
| D. | 氧化剂与还原剂的物质的量之比为5:1 |
18.水的电离平衡为H2O═H+﹢OH-,下列叙述错误的是( )
| A. | 向水中加入少量NH4Cl固体,水的电离程度增大 | |
| B. | 向水中投入金属钾,水的电离平衡向右移动 | |
| C. | 向水中加入浓氨水,c(OH-)增大 | |
| D. | 保持温度不变,向水中加入少量NaOH固体,Kw增大 |
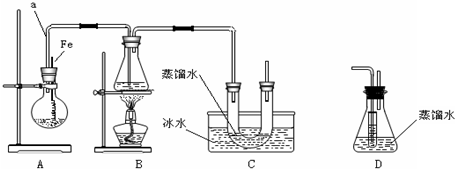
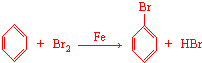 .
.