题目内容
1.取4.35g MnO2与足量的浓盐酸共热产生氯气,试计算:(1)产生氯气的体积是多少?(标准状况下)
(2)参加反应的HCl中有多少g被氧化
(3)共转移多少mol的电子?
分析 n(MnO2)=$\frac{4.35g}{87g/mol}$=0.05mol,
(1)根据转移电子守恒计算生成氯气体积;
(2)根据转移电子守恒计算被氧化HCl质量;
(3)根据二氧化锰和转移电子关系计算转移电子物质的量.
解答 解:n(MnO2)=$\frac{4.35g}{87g/mol}$=0.05mol,
(1)根据转移电子守恒得生成氯气体积=$\frac{0.05mol×2}{2}×22.4L/mol$=1.12L,
答:生成氯气在标况下体积是1.12L;
(2)根据转移电子守恒得被氧化HCl质量=$\frac{0.05mol×2}{1}×36.5g/mol$=3.65g,
答:被氧化氯化氢质量为3.65g;
(3)转移电子物质的量=0.05mol×(4-2)=0.1mol,
答:转移电子物质的量为0.1mol.
点评 本题考查氧化还原反应有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量关系即可解答,题目难度不大.

练习册系列答案
相关题目
11.一定条件下,在容积为1L的密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),1min后测得生成0.06mol NH3,则该段时间内N2的化学反应速率(mol?L-1?min-1)为( )
| A. | 0.01 | B. | 0.02 | C. | 0.03 | D. | 0.06 |
12.实验室里用下列仪器和药品制取纯净的无水氯化铜.根据要求填写下列空白:
(1)如果按气体从左向右流时,②在④左边时,则②中加入液体的名称是饱和食盐水(填名称).
(2)装置⑥中发生反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O.
(3)实验开始时,应先点燃⑤(填装置序号)处的酒精灯,否则CuCl2中含有CuO(填化学式)杂质.待充分反应后,装置①的玻离管中剩余物呈棕黄色.冷却后,将制得的产物配成饱和溶液,溶液呈绿色.
(4)某小组推理反应结束后,⑤中一定有HCl剩余,请设计实验判断这一结论是否正确?加碳酸钠有气泡.
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  | 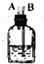 |  |  |  | 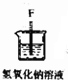 |
(2)装置⑥中发生反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O.
(3)实验开始时,应先点燃⑤(填装置序号)处的酒精灯,否则CuCl2中含有CuO(填化学式)杂质.待充分反应后,装置①的玻离管中剩余物呈棕黄色.冷却后,将制得的产物配成饱和溶液,溶液呈绿色.
(4)某小组推理反应结束后,⑤中一定有HCl剩余,请设计实验判断这一结论是否正确?加碳酸钠有气泡.
9.某氧化剂中,起氧化作用的是X2O72-离子,在溶液中0.2mol该离子恰好能使0.6molSO32-离子完全氧化为SO42-,则X2O72-离子还原后的化合价为( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
6.下列关于Na2CO3和NaHCO3的说法中,不正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 常温下在水中的溶解度:Na2CO3>NaHCO3 | |
| C. | Na2CO3溶液和NaHCO3溶液可用澄清石灰水鉴别 | |
| D. | 相同物质的量Na2CO3和NaHCO3与盐酸完全反应,产生的CO2一样多,消耗HCl的物质的量之比为2:1 |
13.下列关于强、弱电解质的叙述,正确的是( )
| A. | 浓硫酸是强电解质 | |
| B. | 弱电解质在水溶液中一定不能完全电离 | |
| C. | 强电解质的水溶液中不存在分子 | |
| D. | 弱电解质溶液的导电能力一定很弱 |
10.朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾所形成的种种美景的本质原因是( )
| A. | 青雾中的小水滴颗粒大小约为10-9m~10-7m | |
| B. | 光是一种胶体 | |
| C. | 雾是一种胶体 | |
| D. | 发生丁达尔效应 |