题目内容
18.水的电离平衡为H2O═H+﹢OH-,下列叙述错误的是( )| A. | 向水中加入少量NH4Cl固体,水的电离程度增大 | |
| B. | 向水中投入金属钾,水的电离平衡向右移动 | |
| C. | 向水中加入浓氨水,c(OH-)增大 | |
| D. | 保持温度不变,向水中加入少量NaOH固体,Kw增大 |
分析 A.含有弱离子的盐促进水电离;
B.K和水反应生成KOH而使溶液呈碱溶液,酸或碱抑制水电离;
C.一水合氨电离程度大于水电离程度,水中加入浓氨水,c(OH-)增大;
D.水的离子积常数只与温度有关.
解答 解:A.含有弱离子的盐促进水电离,氯化铵是强酸弱碱盐,铵根离子水解而促进水电离,故A正确;
B.K和水反应生成KOH而使溶液呈碱溶液,酸或碱抑制水电离,所以KOH抑制水电离,水的电离平衡向左移动,故B错误;
C.一水合氨电离程度大于水电离程度,水中加入浓氨水,导致溶液中c(OH-)增大,但抑制水电离,故C正确;
D.水的离子积常数只与温度有关,温度不变,水的离子积常数不变,故D错误;
故选BD.
点评 本题水的电离及离子积常数,为高频考点,明确水电离影响因素是解本题关键,注意:离子积常数只与温度有关,与溶液酸碱性、溶液浓度无关,为易错题.

练习册系列答案
相关题目
8.下列叙述错误的是
①若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
②阴、阳离子通过静电吸引形成的化学键叫离子键
③H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
④液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
⑤都是由非金属元素形成的化合物只能是共价化合物( )
①若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
②阴、阳离子通过静电吸引形成的化学键叫离子键
③H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
④液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
⑤都是由非金属元素形成的化合物只能是共价化合物( )
| A. | 全部 | B. | ①②③④⑤ | C. | ①②③⑤ | D. | ②③④ |
9.某氧化剂中,起氧化作用的是X2O72-离子,在溶液中0.2mol该离子恰好能使0.6molSO32-离子完全氧化为SO42-,则X2O72-离子还原后的化合价为( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
6.下列关于Na2CO3和NaHCO3的说法中,不正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 常温下在水中的溶解度:Na2CO3>NaHCO3 | |
| C. | Na2CO3溶液和NaHCO3溶液可用澄清石灰水鉴别 | |
| D. | 相同物质的量Na2CO3和NaHCO3与盐酸完全反应,产生的CO2一样多,消耗HCl的物质的量之比为2:1 |
13.下列关于强、弱电解质的叙述,正确的是( )
| A. | 浓硫酸是强电解质 | |
| B. | 弱电解质在水溶液中一定不能完全电离 | |
| C. | 强电解质的水溶液中不存在分子 | |
| D. | 弱电解质溶液的导电能力一定很弱 |
3.向某密闭容器中充入2molCO和1molH2O(g),发生反应:CO+H2O(g)=CO2+H2,当反应达到平衡时,CO的体积分数为W,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数小于W的是( )
| A. | 2mol CO+0.5mol H2O(g)+1mol CO2+1mol H2 | |
| B. | 1.5mol CO+0.5mol H2O(g)+0.4mol CO2+0.4mol H2 | |
| C. | 1mol CO+1mol H2O(g)+1mol CO2+1mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2 |
10.朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾所形成的种种美景的本质原因是( )
| A. | 青雾中的小水滴颗粒大小约为10-9m~10-7m | |
| B. | 光是一种胶体 | |
| C. | 雾是一种胶体 | |
| D. | 发生丁达尔效应 |
7.对于可逆反应:mA(g)+nB(g)?xC(g)+yD(s)△H=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如图所示,下列判断正确的是( )


| A. | △H>0,m+n>x+y | B. | △H<0,m+n>x+y | C. | △H<0,m+n>x | D. | △H>0,m+n<x |
16.卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它以及表2中的某些物质为原料,按图所示工艺流程进行生产,可制得轻质氧化镁.
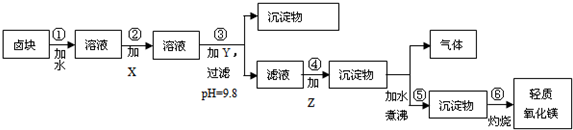
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
*Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去.
表2 原料价格表
(1)在步骤②中加入的试剂X,最佳的选择是漂液NaClO,写出步骤②中pH=1时所发生反应的离子方程式:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O;
(2)在步骤③中加入的试剂是烧碱;之所以要控制pH=9.8,其目的是使Mg2+以外的杂质离子转化成沉淀除去;
(3)某燃料电池的燃料为CO,氧化剂为含CO2的O2,电解质为熔融态的试剂Z(步骤④中加入试剂的有效成分),则该燃料电池的正极电极反应方程式为:O2+4e-+2CO2═2CO32-;
(4)在步骤⑤中发生的反应是MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Mg(OH)2+CO2↑.

若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6* |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
表2 原料价格表
| 物质 | 价格(元•吨-1) |
| 漂液(含25.2% NaClO) | 450 |
| 双氧水(含30% H2O2) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
(2)在步骤③中加入的试剂是烧碱;之所以要控制pH=9.8,其目的是使Mg2+以外的杂质离子转化成沉淀除去;
(3)某燃料电池的燃料为CO,氧化剂为含CO2的O2,电解质为熔融态的试剂Z(步骤④中加入试剂的有效成分),则该燃料电池的正极电极反应方程式为:O2+4e-+2CO2═2CO32-;
(4)在步骤⑤中发生的反应是MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Mg(OH)2+CO2↑.