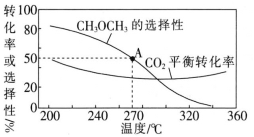
��Ŀ����
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��H2(g) +![]() O2(g) = H2O(l)��H = ��285.8 kJ / mol
O2(g) = H2O(l)��H = ��285.8 kJ / mol
��C(s) + O2(g) = CO2(g)��H = ��393.5 kJ / mol
��C(s) + H2O(g) = CO(g) + H2(g)��H = ��131.5 kJ��mol
��ش�
��1��������Ӧ�����ڷ��ȷ�Ӧ����______������ţ���ͬ�����������ȷ�Ӧ����____��
��2��1 mol H2��ȫȼ������Һ̬ˮ���ų�������Ϊ____kJ��
��3��д�����з�Ӧ���Ȼ�ѧ����ʽ
��1molN2(g)������O2(g)��Ӧ����NO(g)��������68 kJ��������
_______________________________________________
��2 molCu(s) ������O2(g)��Ӧ����CuO(s)���ų�314 kJ������
_______________________________________________
���𰸡��٢� �� 285.8 N2(g)+![]() O2(g)= NO(g) ��H=+68kJ/mol 2Cu(s) +O2(g) =2CuO(s) ��H=-314kJ/mol
O2(g)= NO(g) ��H=+68kJ/mol 2Cu(s) +O2(g) =2CuO(s) ��H=-314kJ/mol
��������
��1����H>0Ϊ���ȷ�Ӧ����H<0Ϊ���ȷ�Ӧ�������ڷ��ȷ�Ӧ���Ǣ٢ڣ��������ȷ�Ӧ���Ǣۣ�
��2����H2(g) +![]() O2(g) = H2O(l)��H = ��285.8 kJ / mol��֪��1 mol H2��ȫȼ������Һ̬ˮ���ų�������Ϊ285.8 kJ��
O2(g) = H2O(l)��H = ��285.8 kJ / mol��֪��1 mol H2��ȫȼ������Һ̬ˮ���ų�������Ϊ285.8 kJ��
��3����д�Ȼ�ѧ����ʽʱ��Ҫ��������ʵľۼ�״̬��ע����H����ֵ����λ����Ӧ��ϵ�������ʵ��������ⲻ�ñ����Ӧ�������������⣬��д���Ȼ�ѧ����ʽ��
��N2(g)+![]() O2(g)= NO(g) ��H=+68kJ/mol��
O2(g)= NO(g) ��H=+68kJ/mol��
��2Cu(s) +O2(g) =2CuO(s) ��H=-314kJ/mol