题目内容
【题目】Ⅰ(1)用CCl4萃取碘水中的碘,下图的分液漏斗中,下层液体呈______色;打开分液漏斗活塞,却未见液体流下,原因可能是_____。
Ⅱ 某同学用某种粗盐进行提纯实验,步骤见下图。
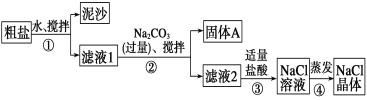
请回答下列问题:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是______________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了____________,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | _______ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | _____ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,________ | _______ | 猜想Ⅲ成立 |
【答案】紫红 分液漏斗上口活塞小孔未与空气相通或者分液漏斗上口活塞未打开 过滤 滴加盐酸至无气泡产生为止 防止溶液飞溅 有气泡放出,澄清石灰水变浑浊 稀盐酸(或稀硝酸) 猜想Ⅱ不成立 滴入BaCl2溶液和稀盐酸溶液 有白色沉淀且不溶于稀盐酸
【解析】
Ⅰ(1)四氯化碳的密度大于水且和水不互溶,四氯化碳能萃取碘,所以有机层在下方,水在上方;如果分液漏斗上口活塞小孔未与空气相通或者分液漏斗上口活塞未打开,则液体不会流出;
Ⅱ 粗盐溶于水,先采用过滤方法除去难溶性泥沙,得到滤液1,向滤液中加入过量碳酸钠溶液,搅拌,然后过滤除去难溶性固体A,得到滤液2,向滤液中加入适量稀盐酸,过量的碳酸钠溶于稀盐酸得到氯化钠,将氯化钠溶液蒸发得到氯化钠晶体;
(1)分离难溶性固体和溶液采用过滤方法;
(2)碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水;步骤④加热蒸发时要用玻璃棒不断搅拌,目的是防止溅出液体;
(3)猜想I:碳酸盐能和稀盐酸反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊;
猜想II:碳酸根离子可以用稀盐酸或稀硝酸检验,钡离子可以用可溶性的硫酸盐检验;
猜想III:要鉴定该混合物中的硫酸根离子,可以用盐酸酸化的氯化钡溶液检验。
Ⅰ(1)四氯化碳的密度大于水且和水不互溶,四氯化碳能萃取碘,所以有机层在下方,水在上方,碘的四氯化碳溶液呈紫红色;如果分液漏斗上口活塞小孔未与空气相通或者分液漏斗上口活塞未打开,则液体不会流出;
故答案为:紫红;分液漏斗上口活塞小孔未与空气相通或者分液漏斗上口活塞未打开;
Ⅱ 粗盐溶于水,然后采用过滤方法除去难溶性泥沙,得到滤液1,向滤液中加入过量碳酸钠溶液,搅拌,然后过滤除去难溶性固体A,得到滤液2,向滤液中加入适量稀盐酸,过量碳酸钠溶于稀盐酸得到氯化钠,将氯化钠溶液蒸发得到氯化钠晶体,
(1)步骤①和②都是将不溶于液体的固体和液体分离,操作方法都是过滤;
故答案为:过滤;
(2)盐酸与过量的碳酸钠反应生成氯化钠、水和二氧化碳,滴加盐酸至无气泡产生为止,说明刚好与碳酸钠反应完;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止局部过热,造成液滴飞溅;当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干;
故答案为:滴加盐酸至无气泡产生为止;防止溶液飞溅;
(3)猜想I:碳酸盐能和稀盐酸反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊,所以可以用澄清石灰水检验二氧化碳,如果有气泡放出且澄清石灰水变浑浊,则说明猜想I成立;
猜想II:碳酸根离子可以用稀盐酸或稀硝酸检验,所以滴加的试剂是稀盐酸或稀硝酸,钡离子可以用可溶性的硫酸盐检验,如果有气泡冒出说明含有碳酸根离子,如果不产生白色沉淀说明不含钡离子,则猜想II不成立;
猜想Ⅲ中要检验硫酸根离子,固体溶于水滴入BaCl2溶液和稀盐酸溶液,观察到有白色沉淀且不溶于稀盐酸,则猜想Ⅲ成立;
故答案为:有气泡放出,澄清石灰水变浑浊;稀盐酸(或稀硝酸);猜想Ⅱ不成立;滴入BaCl2溶液和稀盐酸溶液;有白色沉淀且不溶于稀盐酸。