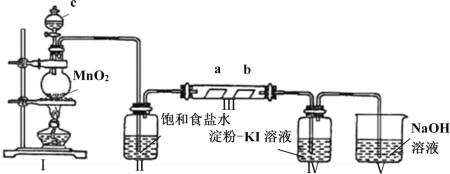
题目内容
【题目】CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g),CO在不同温度下的平衡转化率与压强及温度的关系如图所示。下列说法正确的是( )
CH3OH(g),CO在不同温度下的平衡转化率与压强及温度的关系如图所示。下列说法正确的是( )
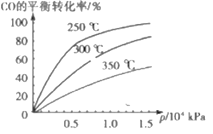
A.该反应的△H>0
B.实际生产选择的压强越高越好
C.使用合适的催化剂,可以降低反应的活化能,提高CO的转化率
D.平衡常数:K350℃<K250℃
【答案】D
【解析】
A选项,画一条与y轴平行的线,从下到上,温度降低,平衡向放热方向移动,y轴CO转化率升高,说明正向移动,即正向为放热反应,故A错误;
B选项,实际生产选择的压强不是越高越好,因此压强高对设备的要求越高,故B错误;
C选项,使用合适的催化剂,可以降低反应的活化能,但平衡不移动,不能提高CO的转化率,故C错误;
D选项,由A得出该反应为放热反应,故升高温度,平衡逆向移动,K值减小,故D正确;
综上所述,答案为D。

练习册系列答案
相关题目