题目内容
19. 稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解.
(1)无水CeCl3可用加热CeCl3•6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是分解出HCl气体,抑制CeCl3的水解.
(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,
Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:2Ce3++1H2O2+6H2O→2Ce(OH)4↓+6H+
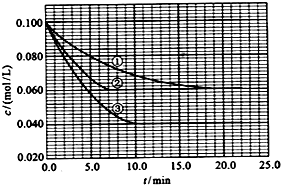
(3)在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.2mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
请回答下列问题:
与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:②加催化剂_;达到平衡的时间缩短,平衡时A的浓度未改变③温度升高;达到平衡的时间缩短,平衡时A的浓度减小; 实验②平衡时B的转化率为40%;该反应是吸热反应,判断其理由是温度升高,平衡向正反应方向移动;
该反应进行到4.0min时的平均反应速度率:实验②:vB=0.014mol(L•min)-1.
分析 (1)在加热条件下CeCl3易发生水解,为抑制其水解,可以通入HCl;
(2)该反应中Ce元素化合价由+3价变为+4价,则Ce3+是还原剂,则双氧水是氧化剂,得电子化合价降低,根据转移电子守恒、原子守恒配平方程式;
(3)在溶液中,压强对化学平衡无影响,且起始浓度不变,应为催化剂与温度对反应的影响,根据催化剂、温度对化学反应速度率和化学平衡的影响;
由图可知,实验②平衡时A的浓度为0.06mol/L,计算A的浓度变化量,再利用方程式计算B的浓度变化量,进而计算平衡时B的转化率;
温度升高,A的浓度降低,平衡向正反应方向移动,据此判断;
根据v=$\frac{△c}{△t}$计算vA,利用速率之比等于速率之比实验②中vB.
解答 解:(1)加热条件下CeCl3易发生水解,为抑制其水解,可以通入HCl,所以无水CeCl3可用加热CeCl3•6H2O和NH4Cl固体混合物的方法来制备目的是分解出HCl气体,抑制CeCl3的水解,故答案为:分解出HCl气体,抑制CeCl3的水解;
(2)该反应中Ce元素化合价由+3价变为+4价,则Ce3+是还原剂,则双氧水是氧化剂,得电子化合价降低,则O元素化合价由-1价变为-2价,转移电子数为2,根据电荷守恒知未知微粒是氢离子,根据转移电子守恒、原子守恒配平方程式为2Ce3++H2O2+6H2O═2Ce(OH)4↓+6H+,故答案为:2;1;6;2;6H+;
(3)与①比较,②缩短达到平衡的时间,因催化剂能加快化学反应速度率,化学平衡不移动,所以②为使用催化剂;
与①比较,③缩短达到平衡的时间,平衡时A的浓度减小,因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,
由图可知,实验②平衡时A的浓度为0.06mol/L,故A的浓度变化量0.1mol/L-0.06mol/L=0.04mol/L,由方程式可知B的浓度变化量为0.04mol/L×2=0.08mol/L,故平衡时B的转化率为$\frac{0.08mol/L}{0.2mol/L}$×100%=40%;
因③温度升高,平衡时A的浓度减小,化学平衡向吸热的方向移动,说明正反应方向吸热,即△H>0,
实验②中,vA=$\frac{0.1mol-0.072mol/L}{4min}$=0.007mol(L•min)-1,所以vB=2vA=0.014mol(L•min)-1
故答案为:②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变;③温度升高;达到平衡的时间缩短,平衡时A的浓度减小;40%;吸;温度升高,平衡向正反应方向移动;0.014mol(L•min)-1.
点评 本题考查盐类水解、氧化还原反应方程式的配平、化学平衡浓度-时间图象、化学反应速率计算、化学平衡影响因素等,注意细心读取图象中物质的浓度,浓度不大侧重考查基本理论,题目难度不大.

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案| A. | B2A3 | B. | B2A | C. | BA2 | D. | BA |
 某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )| A. | 加等量的水后硫酸中水电离出的C(H+)与硫酸铝中水电离出的C(H+)的比值比稀释前的比值增大 | |
| B. | a点溶液中有:c(H+)+c(Al3+)=c(OH-)+c(SO42-) | |
| C. | 体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等 | |
| D. | b、c两溶液水电离出的c(OH-)相等 |
| A. | Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液:Ca2++2HCO3-+Ba2++2OH-=CaCO3↓+BaCO3↓+2H2O | |
| B. | 3molCl2通入含2molFeI2的溶液中:2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2 | |
| C. | 往Ba(OH)2溶液中逐滴加入NH4Al(SO4)2溶液,可能发生反应的离子方程式是Al3++SO42-+Ba2++3OH-=BaSO4↓+Al(OH)3↓ | |
| D. | 向苯酚钠溶液中通入少量的CO2: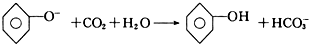 |
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 含有共价键的化合物就是共价化合物 | |
| C. | 含有离子键的化合物就是离子化合物 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
| A. | 一定互为同分异构体 | B. | 一定是同系物,有相同的通式 | ||
| C. | 实验式相同 | D. | 只能是同种物质 |
| A. | CH2═CHCH3 | B. | CH3CH═CHCH3 | C. | (CH3)2C═C(CH3)2 | D. | CH3CH2CH═CH2 |


