题目内容
在下列平衡体系3NO2+H2O 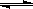 2HNO3+NO中加入O2,则化学平衡
2HNO3+NO中加入O2,则化学平衡
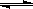 2HNO3+NO中加入O2,则化学平衡
2HNO3+NO中加入O2,则化学平衡| A.不移动 | B.向左移动 | C.向右移动 | D.无法判断 |
C
加入氧气,C(NO)减小C(NO2)增加,平衡向右移动,C正确。

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
题目内容
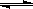 2HNO3+NO中加入O2,则化学平衡
2HNO3+NO中加入O2,则化学平衡| A.不移动 | B.向左移动 | C.向右移动 | D.无法判断 |

 导学全程练创优训练系列答案
导学全程练创优训练系列答案