题目内容
(16分)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)一定条件下,在一个密闭容器中充入气体:N2 2mol、H2 6mol,达平衡后N2的转化率为50%,同时放热92.3KJ。该反应的热化学方程式为:______________________________。
(2)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2 2NH3。
2NH3。
①该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
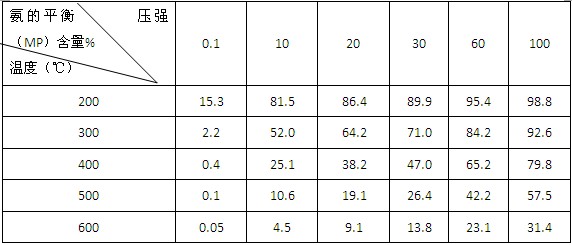
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据, (填温度和压强)。时H2转化率最高,实际工业生产中不选用该条件的主要原因是 。
③下列关于合成氨说法正确是 (填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(3)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,你认为电解质溶液应显 性(填“酸性”、“中性"、“碱性”),写出负极电极反应式 。
(4)工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
(1)一定条件下,在一个密闭容器中充入气体:N2 2mol、H2 6mol,达平衡后N2的转化率为50%,同时放热92.3KJ。该反应的热化学方程式为:______________________________。
(2)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2
 2NH3。
2NH3。①该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据, (填温度和压强)。时H2转化率最高,实际工业生产中不选用该条件的主要原因是 。

③下列关于合成氨说法正确是 (填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(3)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,你认为电解质溶液应显 性(填“酸性”、“中性"、“碱性”),写出负极电极反应式 。
(4)工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
(1) N2(g)+3H2(g)=2NH3(g);⊿H= -92.3KJ/mol。(2分)
(2)①K=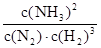 (1分)减小(1分)②200℃、100MPa(2分)
(1分)减小(1分)②200℃、100MPa(2分)
压强太高生产设备条件难以实现(2分) ③B(2分)
(3)碱性(2分) 2NH3-6e- +6OH-=N2+3H2O(2分)
(4)3×10-6 (2)分
(2)①K=
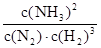 (1分)减小(1分)②200℃、100MPa(2分)
(1分)减小(1分)②200℃、100MPa(2分)压强太高生产设备条件难以实现(2分) ③B(2分)
(3)碱性(2分) 2NH3-6e- +6OH-=N2+3H2O(2分)
(4)3×10-6 (2)分
(1)消耗氮气的量是2mol×50%=1mol,故热化学方程式为N2(g)+3H2(g)
=2NH3(g);⊿H= -92.3KJ/mol。
(2)平衡常数是知在一定条件下可逆反应达到平衡时生成物浓度的幂之积和反应物浓
度的幂之积的比值。正反应放热,升高温度平衡向逆反应方向移动,平衡常数减小。根据表中数据可知在200℃、100Mpa时氨气的物质的量最多,故氢气的转化率最大。虽然加压有利于提供氢气的转化率,但压强太高生产设备条件难以实现。催化剂只能改变反应速率,但不能改变化学平衡状态。根据△G=△H-T△S知,当ΔH<0、ΔS>0时反应自发,但过程但自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的速率。所以答案选B。
(3)氨气易和酸反应生成NH4+,所以电解质溶液应该显碱性。在反应中氨气失去电子
被氧化,在负极通入,电极反应式是2NH3-6e--+6OH-=N2+3H2O。
(7)根据Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)可知
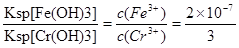 ,所以当溶液中c(Fe3+)为2.0×10-13mol/L时,溶液中c(Cr3+)为3×10-6 mol/L。
,所以当溶液中c(Fe3+)为2.0×10-13mol/L时,溶液中c(Cr3+)为3×10-6 mol/L。
=2NH3(g);⊿H= -92.3KJ/mol。
(2)平衡常数是知在一定条件下可逆反应达到平衡时生成物浓度的幂之积和反应物浓
度的幂之积的比值。正反应放热,升高温度平衡向逆反应方向移动,平衡常数减小。根据表中数据可知在200℃、100Mpa时氨气的物质的量最多,故氢气的转化率最大。虽然加压有利于提供氢气的转化率,但压强太高生产设备条件难以实现。催化剂只能改变反应速率,但不能改变化学平衡状态。根据△G=△H-T△S知,当ΔH<0、ΔS>0时反应自发,但过程但自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的速率。所以答案选B。
(3)氨气易和酸反应生成NH4+,所以电解质溶液应该显碱性。在反应中氨气失去电子
被氧化,在负极通入,电极反应式是2NH3-6e--+6OH-=N2+3H2O。
(7)根据Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)可知
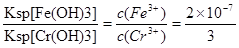 ,所以当溶液中c(Fe3+)为2.0×10-13mol/L时,溶液中c(Cr3+)为3×10-6 mol/L。
,所以当溶液中c(Fe3+)为2.0×10-13mol/L时,溶液中c(Cr3+)为3×10-6 mol/L。
练习册系列答案
相关题目
 Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是( )
Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是( ) 2Z,达到平衡后,X的转化率不可能为( )
2Z,达到平衡后,X的转化率不可能为( )
 2Z,其平衡常数为1600
2Z,其平衡常数为1600 2HNO3+NO中加入O2,则化学平衡
2HNO3+NO中加入O2,则化学平衡 C02(g)+H2(g),部分数据见下表(表中t2>t1):
C02(g)+H2(g),部分数据见下表(表中t2>t1):

 的平衡常数为10。若将
的平衡常数为10。若将 的
的 通人体积为1.0
通人体积为1.0  的密闭容器中,在该温度时的
的密闭容器中,在该温度时的