题目内容
恒温恒容条件下,下列叙述正确的是
A.相同的甲、乙两容器中分别加入1 g SO2、1 g O2与2 g SO2、2 g O2,发生反应2SO2(g)+O2(g)  SO3(g)达到平衡,SO2的转化率前者大 SO3(g)达到平衡,SO2的转化率前者大 |
B.反应2HI(g)  H2(g)+I2(g)达到平衡,增大HI的物质的量,平衡不移动 H2(g)+I2(g)达到平衡,增大HI的物质的量,平衡不移动 |
C.反应2NO2(g )  N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡时,与第一次平衡时相比,NO2的体积分数增大 N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡时,与第一次平衡时相比,NO2的体积分数增大 |
D.反应2HI(g)  H2(g)+I2(g)达到平衡,增大HI的物质的量,HI的分解率和体积分数均不变 H2(g)+I2(g)达到平衡,增大HI的物质的量,HI的分解率和体积分数均不变 |
D
A中后者c(SO2)、c(O2)大,则压强大,所以后者SO2的转化率大;
B中增大HI的物质的量,即增大了c(HI),平衡右移;但压强的增大不影响平衡移动,所以达到的新平衡态与原平衡态相同,故D正确;
C中再向容器内通入一定量的NO2(g),即增大了c(NO2),平衡右移,所以:重新达到平衡时,与第一次平衡时相比,NO2的体积分数减小;
B中增大HI的物质的量,即增大了c(HI),平衡右移;但压强的增大不影响平衡移动,所以达到的新平衡态与原平衡态相同,故D正确;
C中再向容器内通入一定量的NO2(g),即增大了c(NO2),平衡右移,所以:重新达到平衡时,与第一次平衡时相比,NO2的体积分数减小;

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
 2HI达到化学平衡状态的标志是( )
2HI达到化学平衡状态的标志是( )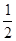 v(HI)
v(HI)
 2Z,其平衡常数为1600
2Z,其平衡常数为1600 2HNO3+NO中加入O2,则化学平衡
2HNO3+NO中加入O2,则化学平衡 C02(g)+H2(g),部分数据见下表(表中t2>t1):
C02(g)+H2(g),部分数据见下表(表中t2>t1):

 达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示。下列有关叙述一定正确的是
达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示。下列有关叙述一定正确的是

 x C(g)+2D(g)ΔH <0 ,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.2mol/L。由此推断:
x C(g)+2D(g)ΔH <0 ,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.2mol/L。由此推断: ① x值等于 ; ② B的平衡浓度为 。
① x值等于 ; ② B的平衡浓度为 。