题目内容
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+ +6HCHO =3H++6H2O+(CH2)6N4H+ (滴定时,1mol(CH2)6N4H+与 lmolH+相当),然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试剂,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。根据以上步骤完成下列空白:
(1)锥形瓶用蒸馏水洗涤后,再用样品溶液洗涤,则测得样品中氮的质量分数将_______(填“偏高”、“偏低”或“无影响”)。
(2)滴定前俯视碱式滴定管读数,滴定结束后仰视碱式滴定管读数,则测得样品中氮的质量分数将________(填“偏高”、“偏低”或“无影响”)。
(3)滴定时边滴边摇动锥形瓶,眼睛应观察____________
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
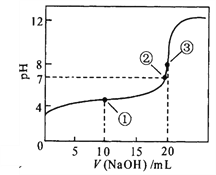
(4)滴定达到终点时的标志是________________________________________。
(5)滴定结果如下表所示:
滴定 次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数为___________。
【答案】 偏高 偏高 B 溶液由无色变为粉红(或浅红),且半分钟内不褪色 18.67%
【解析】(1)锥形瓶用蒸馏水洗涤后,再用样品溶液洗涤,导致取用的样品的量偏多,滴定消耗的标准溶液偏多,根据c(待测)= 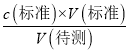 ,c(待测)偏高,故答案为:偏高;
,c(待测)偏高,故答案为:偏高;
(2)滴定前俯视碱式滴定管读数,滴定结束后仰视碱式滴定管读数,导致标准溶液的体积偏大,根据c(待测)= 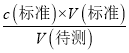 ,c(待测)偏高,故答案为:偏高;
,c(待测)偏高,故答案为:偏高;
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察锥形瓶内溶液颜色变化,确定滴定终点,故答案为:B;
(4)待测液为酸性,酚酞应为无色,当溶液转为碱性时,溶液颜色变为粉红(或浅红),故答案为:溶液由无色变为粉红(或浅红),且半分钟内不褪色;
(5)标准溶液的体积应取三次实验的平均值,首先确定滴定时所用的NaOH标准溶液为![]() mL=20.00mL,根据题意中性甲醛溶液一定是过量的,而且1.500g 铵盐经溶解后,取了其中
mL=20.00mL,根据题意中性甲醛溶液一定是过量的,而且1.500g 铵盐经溶解后,取了其中![]() 进行滴定,即0.15g,滴定后溶液中含有H+(含(CH2)6N4H+)共0.02L×0.1000mol/L=0.00200mol,根据4NH4++6HCHO═3H++6H2O+(CH2)6N4H+,每生成4molH+(含(CH2)6N4H+),会消耗NH4+4mol,所以共消耗NH4+0.00200mol,其中含氮元素0.00200mol×14g/mol=0.02800g,所以氮的质量分数为
进行滴定,即0.15g,滴定后溶液中含有H+(含(CH2)6N4H+)共0.02L×0.1000mol/L=0.00200mol,根据4NH4++6HCHO═3H++6H2O+(CH2)6N4H+,每生成4molH+(含(CH2)6N4H+),会消耗NH4+4mol,所以共消耗NH4+0.00200mol,其中含氮元素0.00200mol×14g/mol=0.02800g,所以氮的质量分数为![]() ×100%=18.67%,故答案为:18.67%。
×100%=18.67%,故答案为:18.67%。

 阅读快车系列答案
阅读快车系列答案【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次(从左至右)发生反应的类型和条件都正确的是( )
选项 | 反应类型 | 反应条件 |
A | 加成反应、取代反应、消去反应 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去反应、加成反应、取代反应 | NaOH醇溶液/加热、常温、NaOH水溶液/加热 |
C | 氧化反应、取代反应、消去反应 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去反应、加成反应、水解反应 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A.A
B.B
C.C
D.D