题目内容
【题目】磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种
能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式
为LixC6+Li1-xFePO4 ![]() LiFePO4+6C。下列说法正确的是( )
LiFePO4+6C。下列说法正确的是( )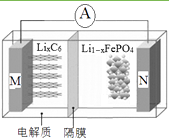
A.放电时Li+从右边移向左边
B.放电时M是负极,电极反应式为:C6x--xe-=6C
C.充电时N极连接电源的正极,电极反应式为:LiFePO4-xe-=Li1-xFePO4+xLi+
D.充电时电路中通过0.5mol电子,消耗36gC
【答案】C
【解析】解:A、放电过程中,M 极是负极,Li+从左边移向右边,A 错误;
B、放电过程中,M 电极为负极,反应为 LixC6-xe-=6C+xLi+,B 错误;
C、充电时N极连接电源的正极,电极反应式为:LiFePO4-xe-=Li1-xFePO4+xLi+ , C 正确;
D、根据方程式可知充电时每消耗 6mol 碳,转移 xmol 电子,因此电路中通过 0.5mol 电子,消耗 36g/x 碳,D 错误;
答案选 C。

【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+ +6HCHO =3H++6H2O+(CH2)6N4H+ (滴定时,1mol(CH2)6N4H+与 lmolH+相当),然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试剂,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。根据以上步骤完成下列空白:
(1)锥形瓶用蒸馏水洗涤后,再用样品溶液洗涤,则测得样品中氮的质量分数将_______(填“偏高”、“偏低”或“无影响”)。
(2)滴定前俯视碱式滴定管读数,滴定结束后仰视碱式滴定管读数,则测得样品中氮的质量分数将________(填“偏高”、“偏低”或“无影响”)。
(3)滴定时边滴边摇动锥形瓶,眼睛应观察____________
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(4)滴定达到终点时的标志是________________________________________。
(5)滴定结果如下表所示:
滴定 次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数为___________。