题目内容
【题目】在一定条件下,在4L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,据图分析回答下列问题: 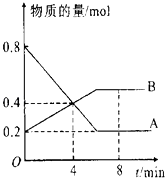
(1)请问哪条曲线代表反应物;
(2)该反应为可逆反应,请说明依据;
(3)反应开始至4min时,A的平均反应速率为 , 此时V正V逆(填“>”“<”或“=”);
(4)8min时,反应是否达平衡状态?(填“是”或“否”);
(5)反应进行至4min时,反应物的转化率为 .
【答案】
(1)A
(2)原因是反应到最后反应物的浓度不为零,且与生成物共存
(3)0.025mol/(L?min);>
(4)是
(5)50%
【解析】解:(1)反应物在反应过程中物质的量在减少,生成物在反应过程中物质的量在增加,图象分析,A物质的量在减少为反应物,B物质的量在增加为生成物,物质的量不变化说明反应达到平衡状态,所以答案是:A;(2)可逆反应是指在同一条件下,既能向生成物方向进行,同时又能向反应物方向进行的反应,任何可逆反应中,反应到最后反应物的浓度不为零,图象分析A、B最终浓度不为零,反应物和生成物共存,为可逆反应,所以答案是:原因是反应到最后反应物的浓度不为零,且与生成物共存;(3)反应开始至4min时,A物质的量变化=0.8mol﹣0.4mol=0.4mol,A的平均反应速率为V= ![]() =
= ![]() =0.025mol/(Lmin),物质的量不变化说明反应达到平衡状态,4min时AB物质的量发生变化,说明未达到平衡,可逆反应在达到平衡前,正反应速率大于逆反应速率,所以此时V正>V逆 , 所以答案是:0.025mol/(Lmin);>;(4)图象分析可知,随时间变化AB物质的量发生变化说明未达到平衡,达到平衡状态,反应继续进行,正逆反应速率相等,各组分的浓度不再变化,8min时,AB物质的量不变,依据AB消耗的物质的量之比计算得到化学方程式的计量数之比,A物质的量变化=0.8mol﹣0.2mol=0.6mol;B变化物质的量=0.5mol﹣0.2mol=0.3mol,AB反应的物质的量之比2:1,所以反应的化学方程式:2AB,所以答案是:是;(5)图象分析,A物质的量在减少为反应物,反应进行至4min时,A减少0.8mol﹣0.4mol=0.4mol,转化率=
=0.025mol/(Lmin),物质的量不变化说明反应达到平衡状态,4min时AB物质的量发生变化,说明未达到平衡,可逆反应在达到平衡前,正反应速率大于逆反应速率,所以此时V正>V逆 , 所以答案是:0.025mol/(Lmin);>;(4)图象分析可知,随时间变化AB物质的量发生变化说明未达到平衡,达到平衡状态,反应继续进行,正逆反应速率相等,各组分的浓度不再变化,8min时,AB物质的量不变,依据AB消耗的物质的量之比计算得到化学方程式的计量数之比,A物质的量变化=0.8mol﹣0.2mol=0.6mol;B变化物质的量=0.5mol﹣0.2mol=0.3mol,AB反应的物质的量之比2:1,所以反应的化学方程式:2AB,所以答案是:是;(5)图象分析,A物质的量在减少为反应物,反应进行至4min时,A减少0.8mol﹣0.4mol=0.4mol,转化率= ![]() ×100%=
×100%= ![]() =50%,所以答案是:50%.
=50%,所以答案是:50%.
【考点精析】掌握化学平衡的计算是解答本题的根本,需要知道反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 阅读快车系列答案
阅读快车系列答案